
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
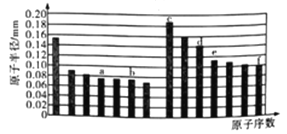
A. a的最高价氧化物与e的最高价氧化物结构相似,都为酸性氧化物且不能与任何酸反应
B. b、c、d、f四种元素的简单离子半径比较: f>b>c>d
C. c、d分别与f组成的化合物均为离子化合物
D. a、f的氧化物对成的水化物酸性及气态氢化物的稳定性f>a
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
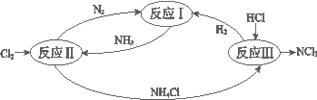
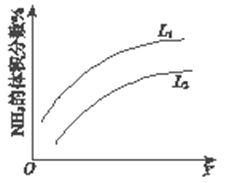
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
2NH3(g) ΔH=–92 kJmol-1。上图是反应I中平衡混合气中NH3的体积分数(V%)随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中横坐标X代表的是__________(填“温度”或“压强”),L1__________ L2(填“>”或“<”或“=”) 。
(2)反应II其中一步反应为2NH3(g)+3Cl2(g) =N2(g)+6HCl(g)ΔH=–462 kJmol-1
已知:![]() 断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
断开2 mol H–N键与断开2 mol H–Cl键所需能量相差约为_______kJ。
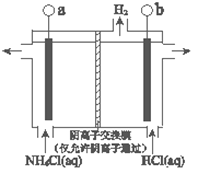
(3)反应III是利用下图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
①b接电源的_______(填“正”或“负”)。
②阳极反应式是_______。
(4)反应III得到的NCl3可以和NaClO2制备ClO2,同时生成NH3,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计从模拟海水中制备MgO的实验方案:
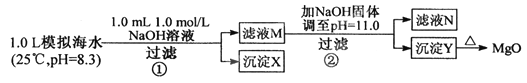
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
【注】溶液中某种离子的浓度小于1.0![]() 10-5mol
10-5mol![]() L-,可认为该离子不存在。
L-,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:
Ksp(CaCO3)=4.96![]() 10-9 Ksp(MgCO3)=2.1
10-9 Ksp(MgCO3)=2.1![]() 10-5
10-5
Ksp(Ca(OH)2)=4.68![]() 10-6 Ksp(Mg(OH)2)=5.61
10-6 Ksp(Mg(OH)2)=5.61![]() 10-12
10-12
下列说法正确的是
A. 沉淀物x为CaCO3
B. 滤液M中存在Mg2+ ,不存在Ca2+
C. 滤液N中存在Mg2+ , Ca2+
D. 步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是

A. 分子式分别为 C10H16ON、C2H7NO2S
B. 均能与金属钠及氢氧化钠溶液反应
C. 均能发生取代反应,麻黄碱还能发生加成反应
D. 牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
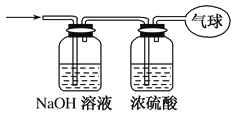
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)

请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
① _________________________________________;
④ _________________________________________;
⑤ _________________________________________。
(3)写出C溶液与Al反应的化学方程式____________________。
(4)浓硫酸具有强氧化性却可以用B材料车运输,是因为_________________。
(5)为鉴定B单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_____________。
A. 碘水 B. NaOH溶液 C. KSCN溶液 D. Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g)![]() -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g )![]() N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g)![]() 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) ![]() 2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
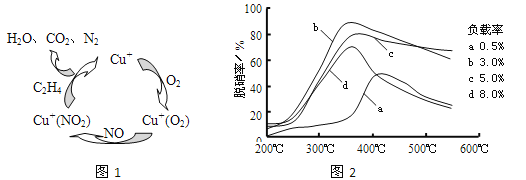
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
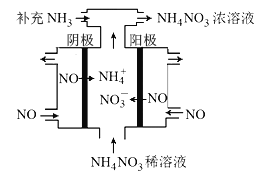
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关AgCl沉淀的溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KI,NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr
B.KCl和NaCl
C.KCl和NaBr
D.KCl、NaCl和I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com