
下列关于氯气的叙述,不正确的是( )
A.氯气是一种有毒的气体 B.氯气、氯水、液氯是同一种物质
C.氯气能与水发生反应 D.氯气是一种黄绿色,有刺激性气味的气体
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源:2017届河北省高三上学期第二次月考化学卷(解析版) 题型:选择题
一包混有杂质的碳酸钠固体,其杂质可能是Ba(NO3)2、KCl及NaHCO3中的一种或两种,今取样品溶于适量水得到澄清溶液。另取5.3g样品,加入足量的盐酸,收集到2.2gCO2,则 下列判断正确的是
下列判断正确的是
A.样品中只含有一种杂质NaHCO3
B.样品中含有有KCl,不含有NaHCO3
C.样品中含有Ba(NO3)2和NaHCO3
D.样品中含有KCl和NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上10月月考化学试卷(解析版) 题型:选择题
我国科学家近期研究发现。NaHCO3可显著结合癌细胞中乳酸电离出的H+,从而间接地“饿死”癌细胞,下列说法中不正确的是
A.NaHCO3为弱电解质 B.H2CO3的酸性弱于乳酸
C.NaHCO3也可以用来治疗胃酸过多 D.NaHCO3固体中含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
下列有关离子(或物质)的检验及结论,正确的是( )
A.用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体
B.焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色
C.检验Na2CO3固体 中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体
中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体
D.向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于区域3的是( )
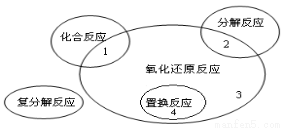
A.Cl2 + 2KBr Br2 + 2KCl
B.2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C.4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
D.CH4 + 2O2 CO2 + 2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
发现原子中存在电子的科学家是( )
A. 英国科学家道尔顿 B. 英国科学家汤姆生
C. 英国科学家卢瑟福 D. 丹麦物理学家玻尔
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上10月月考化学试卷(解析版) 题型:填空题
在25℃时,用石墨电极电解2.0L 2.5 mol.L -1CuSO4溶液,如有0.2 mol电子发生转移,请回答下列问题:
⑴阳极发生__________反应,电极反应式为 ___________________________。
⑵电解后得到的铜的质量是___________,得到氧气的体积是__________(标准状况),溶液的pH是___________。
⑶如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上10月月考化学试卷(解析版) 题型:选择题
关于如图所示装置的叙述正确的是( )

A.甲、乙装置中的锌片都作负极
B.甲、乙装置中的溶液内的H+在铜片被还原
C.甲、乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片有气泡生成,乙装置中的铜片质量减小
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三上10月高考模拟化学试卷(解析版) 题型:实验题
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:

(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO4-+Fe2++H+=Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00g硫酸亚铁铵晶体,配制成100ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.1000mol·L-1 KMnO4 溶液滴定至终点,重复两次,平均消耗KMnO4 溶液16.00 mL。
①如何判断滴定终点? ,
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为 ,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com