
下列叙述正确的是
A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL
B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大
C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大
D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+)
BD
【解析】
试题分析:c(H+)=10—pHmol/L=0.1mol/L,HCl完全电离,CH3COOH部分电离,则c(HCl)=
0.1mol/L,c(CH3COOH)>0.1mol/L,由于n=c•V,则n(HCl)<n(CH3COOH),因此醋酸消耗NaOH溶液的体积较多,大于20.0mL,故A选项错误;由于Na2CO3=2Na++CO32—,钠离子不水解,碳酸根离子存在水解平衡,即CO32—+H2O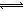 HCO3—+OH—,则向稀碳酸钠溶液中加入少量NaOH固体时,钠离子和氢氧根离子浓度均增大,增大生成物浓度,导致碳酸根离子的水解平衡向逆反应方向移动,则碳酸根离子浓度增大,故B选项正确;氯化银是难溶电解质,因此其悬浊液中存在沉淀溶解平衡,即AgCl(s)
HCO3—+OH—,则向稀碳酸钠溶液中加入少量NaOH固体时,钠离子和氢氧根离子浓度均增大,增大生成物浓度,导致碳酸根离子的水解平衡向逆反应方向移动,则碳酸根离子浓度增大,故B选项正确;氯化银是难溶电解质,因此其悬浊液中存在沉淀溶解平衡,即AgCl(s)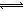 Ag++Cl—,氯化纳是易溶易电离物,加入少量NaCl固体,增大氯离子浓度,上述平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度减小,但温度不变平衡常数不变,则Ksp(AgCl)不变,故C选项错误;由于n=c•V,则n(CH3COONa)=n(CH3COOH),根据物料守恒原理可得,混合溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),故D选项正确。
Ag++Cl—,氯化纳是易溶易电离物,加入少量NaCl固体,增大氯离子浓度,上述平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度减小,但温度不变平衡常数不变,则Ksp(AgCl)不变,故C选项错误;由于n=c•V,则n(CH3COONa)=n(CH3COOH),根据物料守恒原理可得,混合溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),故D选项正确。
考点:考查水溶液中的离子平衡移动及粒子浓度大小关系,涉及等pH等体积的强酸与弱酸溶液中和氢氧化钠溶液体积的大小、盐类水解反应的移动、沉淀溶解平衡的移动、溶度积与平衡移动的关系、等浓度等体积弱酸与强碱弱酸盐溶液混合后溶液中物料守恒关系式等。


科目:高中化学 来源: 题型:
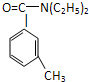 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH| SOCl2 |
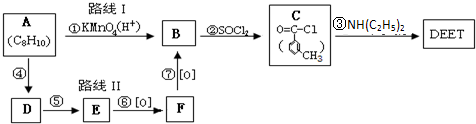
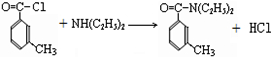
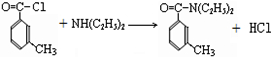
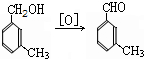

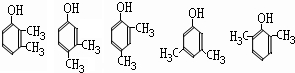 (任写2种)
(任写2种) (任写2种)
(任写2种)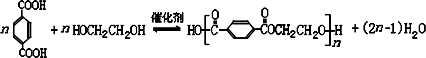

查看答案和解析>>
科目:高中化学 来源: 题型:
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:
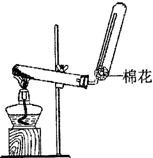 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
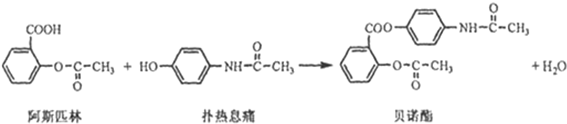
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com