
| A����״���£�������ΪNA��N2��C2H4��������������Ϊ28g |
| B��0.1 mol Mg�ڿ�������ȫȼ������MgO��Mg3N2��ת�Ƶĵ�����ĿΪ0.2 NA |
| C��60gCaCO3��KHCO3�Ļ�������������ᷴӦ����CO2������Ϊ0.6NA |
| D����0.2 mol Mg��OH��2��0.3 mol NaOH�ֱ�����ˮ�������100mL��Һ��������Һ������������Ϊ0.6NA |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��OH- |
| B��NH3 |
| C��O2- |
| D��H3O+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ֹ��Ʊ������費�漰������ԭ��Ӧ |
| B������ʦ���������ʴʯӢ��������Ʒ |
| C��ˮ�������Ͳ����ϵĴ��̶��ǹ�������Ʒ |
| D������Ŀǰ���ཫ̫����ת��Ϊ���ܵ���Ҫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1��5 | B��4��1 |
| C��5��1 | D��1��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ı�ȼ���ȡ�H=-890.3 kJ?mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3 kJ?mol-1 |
B����ϩ�ļ���ʽ��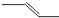 |
| C��һ�������£�ij�ܱ������г���2mol SO2��g����1molO2��g�����ﵽƽ��ų�QkJ��������������µ��Ȼ�ѧ����ʽΪ��2SO2��g��+O2��g��?2SO3��g ����H=-Q kJ?mol-1 |
| D����ϩ�Ľṹ��ʽ��CH2CH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����з�Ӧ��ļ���֮��С������������ļ���֮�͵ķ�ӦΪ���ȷ�Ӧ |
| B�����з�Ӧ���������С��������������������ķ�ӦΪ���ȷ�Ӧ |
| C���к����뻯ѧ��Ӧ����ʽ�ļ����������� |
| D�����������������������ķ�ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������к͵ζ�ʱ����10mL��Ͳ��ȡ10.00mL����Һ |
| B����������ƽ����25.20gNaCl���� |
| C�����������£��ù㷺pH��ֽ��ô�ˮ��pHΪ7.0 |
| D����500mL����ƿ����480mL0.1000mol/LNaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ClO2��Cl- |
| B��Zn��Zn2+ |
| C��H2��H2O |
| D��CuO��CuCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
| c(HCO3) | ||
c(C
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com