
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
(1)①B ②0.1 (2)①Cl--5e-+2H2O=ClO2↑+4H+
②0.01 在阴极上发生反应2H++2e-=H2↑,H+浓度减小,使得H2O??
OH-+H+的平衡向右移动,OH-浓度增大,pH增大
(3)2ClO2+2CN-=N2↑+2CO2↑+2Cl- 50a/13
【解析】 (1)分析元素化合价可知,浓盐酸中的氯元素转化成氯气和NaCl,故浓盐酸在反应中显示出还原性和酸性。由反应知,每生成2 mol ClO2转移2 mol电子。(2)①电解饱和食盐水制取ClO2,ClO2为氧化产物,故应在阳极产生,Cl-失去5个电子生成ClO2,而ClO2中含有氧元素,故还有H2O参加反应,再根据质量守恒配平电极反应式即可。②阴极产生标准状况下112 mL H2,转移电子0.01 mol,消耗的n(H+)=0.01 mol,为保持溶液呈电中性,故有相同物质的量的Na+通过阳离子交换膜移向阴极。阴极上H2O电离出的H+放电,导致H2O的电离平衡向右移动,OH-浓度增大,溶液pH增大。(3)处理污水时生成的两种气体不能具有污染性,应为CO2和N2,再根据得失电子守恒和原子守恒配平即可。由离子反应方程式可知消耗的ClO2的物质的量等于污水中CN-的物质的量,即n(ClO2)=n(CN-)= mol。
mol。


科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

用上表中的字母代号回答下列问题:
(1)属于卤族元素的有_________________________________________;
(2)属于稀有气体元素的有_____________________________________;
(3)属于第ⅠA金属元素的有___________________________________;
(4)写出c元素在周期表中的位置_______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )。

P4分子结构模型
A.常温常压下,16 g14CH4中所含的中子数为8NA
B.标准状况下,22.4 L CCl4中所含的分子数为NA
C.在1 L 1.0 mol·L-1 NaCl溶液中含有NA个NaCl分子
D.6.2 g白磷(分子式为P4,分子结构如图所示)中所含的P—P键数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )。

A.分子含有4个手性碳原子
B.能使酸性高锰酸钾溶液褪色
C.分子有3种含氧官能团
D.分子中所有碳原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
下列实验操作能够达到实验目的的是( )。

A.用激光笔鉴别淀粉溶液和蔗糖溶液
B.实验室采用上图所示装置收集SO2
C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D.配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )。
A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
B.金刚石是自然界中硬度最大的物质,高温下可与氧气发生反应
C.浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:填空题
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是
___________________________________________________(填序号)。

a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH

实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入________(填化学式),电极反应式为________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg/L的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第7讲水溶液中的离子平衡练习卷(解析版) 题型:选择题
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )。

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时c(H+)=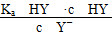 +c(Z-)+c(OH-)
+c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
X、Y是元素周期表中ⅦA族的两种元素,下列能说明X的非金属性比Y强的是( )。
A.电子层数:X>Y
B.气态氢化物的稳定性:HX<HY
C.酸性:HXO4>HYO4
D.能发生置换反应:Y2+2NaX=X2+2NaY
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com