
三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构。下列对NCl3的有关描述正确的是( )
A.NCl3是三角锥形结构,故它是非极性分子
B.NCl3分子间可形成氢键,故它比PCl3难挥发
C.NCl3有孤电子对,它还能以配位键的形式再与一个Cl-结合
D.NCl3分子中不存在非极性共价键
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
下列各组物质中,不能按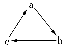 (“→”表示一步转化)关系相互转化的是( )
(“→”表示一步转化)关系相互转化的是( )
选项abc
AH2OO2Fe(OH)3
BNaNa2ONaCl
CCNO2HNO3
DFeCl2FeFeCl3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.高温水解Al2O3可制得金属铝
C.MgO的熔点很高,可用于制作耐高温材料
D.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-3 分子空间结构与物质性质练习卷(解析版) 题型:填空题
(1)图1为元素X的前五级电离能的数值示意图。已知X的原子序数<20,请写出X基态原子的核外电子排布式 。
(2)A、B、C、D、E、F、G、H八种短周期元素,其单质的沸点如图2所示。
请回答:
①上述元素中,某些元素的常见单质所形成的晶体为分子晶体,这些单质分子中既含有σ键又含有π键的是 (填化学式)。
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) 。
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华。据此推测该化合物的化学键类型为 。
④原子序数比A小1的元素与D元素形成的化合物的空间构型为 ,中心原子的杂化方式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-3 分子空间结构与物质性质练习卷(解析版) 题型:选择题
已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )
A.分子中所有原子在同一平面内
B.分子中不含氢原子
C.在ABn分子中,A元素为最高正价
D.在ABn型分子中,A原子最外层电子都已成键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-2 微粒间作用力与物质性质练习卷(解析版) 题型:填空题
Ⅰ.下列说法中正确的是 。
A.SO2和O3、PO43-和ClO4-互为等电子体
B.甲烷分子失去一个H+,形成CH3-,其碳原子的杂化类型发生了改变
C.Ti原子的核外电子排布式为[Ar]3d34s2
D.CS2、H2O、C2H2都是直线形分子
E.CH4、BCl3、CO2都是含有极性键的非极性分子
Ⅱ.立方氮化硼是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
(2)如图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3(只要求列出算式)。

(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因: 。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-2 微粒间作用力与物质性质练习卷(解析版) 题型:选择题
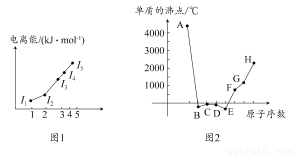
下图是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,图中: —X、
—X、 —Y,
—Y, —Z。其对应的化学式不正确的是( )
—Z。其对应的化学式不正确的是( )
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷(解析版) 题型:选择题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 11-5 羧酸 酯练习卷(解析版) 题型:填空题
呋喃酚是合成农药的重要中间体,其合成路线如下:
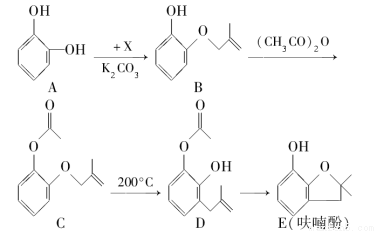
(1)A在空气中久置会由无色转变为棕褐色,其原因是________,A在核磁共振氢谱中有________组峰。
(2)B→C的反应类型是________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:________________。
(4)要鉴别化合物C和D,适宜的试剂是________。
(5)B的同分异构体很多,符合下列条件的有________种,写出其中能发生银镜反应的同分异构体的结构简式:________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com