【答案】
分析:A.二氧化碳是直线型分子;
B.路易斯结构式就是用短棍表示共价键,用小黑点表示非键合的孤电子对的结构式,也叫电子结构式;
C.sp
3杂化道图是正四面体结构;
D.π键是原子间p电子肩并肩重叠形成的.
解答:解:A.二氧化碳是直线型分子,该分子模型是V型分子模型示意图,故A错误;
B.路易斯结构式就是用短棍表示共价键,用小黑点表示非键合的孤电子对的结构式,也叫电子结构式,所以HClO的路易斯结构式为

,故B错误;
C.一个s轨道和3个p轨道杂化,形成4个sp
3杂化道,其空间构型是正四面体构型,故C正确;
D.π键是由两个原子的p电子肩并肩重叠形成的,所以其电子云图为:

,故D正确;
故选AB.
点评:本题考查了化学用语,难度不大,注意π键的形成方式、路易斯结构式的书写.


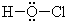


 ,故B错误;
,故B错误; ,故D正确;
,故D正确;

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案