
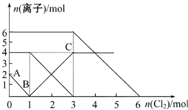
 向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中正确的是( )| A. | 离子的还原性顺序为:Fe2+>Br->I- | |
| B. | 原混合溶液中FeBr2的物质的量为4mol | |
| C. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 | |
| D. | 当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
分析 首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,以此解答该题.
解答 解:A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A错误;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;
C.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故C正确;
D.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故D正确.
故选CD.
点评 本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,难度较大,解答本题时注意根据离子的还原性强弱结合图象判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点,答题时注意体会.


科目:高中化学 来源: 题型:选择题
| A. | ②④⑦ | B. | ②⑤⑥ | C. | ①⑤⑦ | D. | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
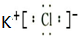 ,B元素基态原子的电子排布图为
,B元素基态原子的电子排布图为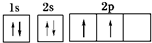 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏、石油的分馏分别是化学变化、物理变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者是同分异构体 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 饱和(NH4)2SO4溶液和饱和CuSO4溶液都能使蛋白质溶液产生沉淀,其作用原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称取7.68gCuSO4,加入500mL水 | B. | 称取12.0g胆矾,配成480mL溶液 | ||
| C. | 称取8.0gCuSO4,加入500mL 水 | D. | 称取12.5g胆矾,配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、S、Cl最高正价依次升高 | |
| B. | Li、Be、B原子最外层电子数逐渐增多 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com