
科目:高中化学 来源: 题型:
| A、不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱液沾到皮肤上,要立即用大量的稀硫酸冲洗 |
| C、酒精灯着火时可用水扑灭 |
| D、稀释浓硫酸时,可往装有一定体积浓硫酸的量筒中,慢慢加入水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某可逆反应X(g)+Y(g)?Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:
某可逆反应X(g)+Y(g)?Z(g)+2W(g),其化学平衡常数K和温度的关系如下表:| T/℃ | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
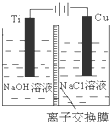 纳米级Cu2O由于具有优良的催化性能而受到关注,如表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,如表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 光照 |
| CU2O |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有Al2(SO4)3和MgCl2的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量(W)与加入NaOH溶液的体积关系如图所示,则原溶液中SO42-与Cl-的物质的量之比为( )
现有Al2(SO4)3和MgCl2的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量(W)与加入NaOH溶液的体积关系如图所示,则原溶液中SO42-与Cl-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、2:3 | D、2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com