
 发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效
发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效分析 ①根据含铜的离子的结构图分析,Cu与N元素间形成配位键,C与N之间形成极性键,C与C之间形成非极性键;
②根据形成氢键的条件分析,氢键是分子间作用力的一种,F、O、N的电负性较强,对应的氢化物分子之间能形成氢键;
③利用甲醇中的成键来分析原子的杂化类型;利用判断σ键的规律来分析σ键数目.
解答 解:①根据含铜的离子的结构图分析可知,Cu与N元素间形成配位键,C与N之间形成极性键,C与C之间形成非极性键;
故答案为:b、c、d;
②电负性较强的元素如N、O、F与H形成共价键时,能形成氢键,而C的电负性较弱,与H形成共价键后,不能形成氢键,(或甲醛分子中的氢不够活泼、不够显电正性等),
故答案为:甲醛分子中氢原子与碳原子形成共价键,碳的电负性较小,不构成形成氢键的条件(或甲醛分子中的氢不够活泼、不够显电正性等);
③甲醇分子中C原子形成4个单键,即C含有4个σ键电子对,所以是sp3杂化,甲醇中O含有2个4个σ键电子对和2个孤电子对,所以O原子为sp3杂化;甲醛中含有一个C=O,C=O由1个π键和1个σ键构成,所以甲醛与H2发生加成反应,当生成1mol甲醇,断裂σ键的数目为NA,
故答案为:C、O; NA.
点评 本题考查了元素的推断,涉及氢键、化学键的判断、杂化等,注意把握杂化轨道理论高频考点的熟练应用,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| C. | 点燃的镁条插入盛有N2的集气瓶中,立即熄灭 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中K+浓度是0.4 mol•L-1 | |
| B. | 溶液中含有0.4NA个K+ | |
| C. | 1 L溶液中所含K+、SO42-总数为0.3NA | |
| D. | 2 L溶液中SO42-浓度是0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64g Cu片(0.01mol)和20.0mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶液B,… |
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01mol Cu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| 3、加水稀释 | 溶液立即变为蓝色 | |
| 实验4 | i.向20.0mL 0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


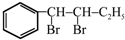



 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为
与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为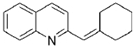 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
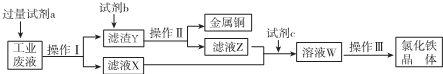
| A. | 试剂a是铁、试剂b是稀硫酸 | |
| B. | 操作I、操作Ⅱ、操作Ⅲ所用仪器相同 | |
| C. | 试剂c可以是H2O2溶液或氯气 | |
| D. | 用酸性KMnO4溶液可检验溶液W中是否还有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com