
【题目】下列有关物质的性质与用途具有对应关系的是
A. 医用酒精能使蛋白质变性,可用于消毒杀菌
B. SiO2有很好的折光率,可以用来做半导体材料
C. 水玻璃易溶于水,可用于生产黏合剂和防火剂
D. 氯化铝是强电解质,可电解其水溶液获得金属铝
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】仔细分析下列表格中烃的排列规律,判断排列在第16位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | …… |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | …… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13 个电子。则
(1)B的原子结构示意图为 ;X的化学名称为 。
(2)B单质的电子式为 ;E的气态氢化物的结构式为 ;C与D形成的两种化合物中,原子个数比为1:1的那种物质所含有的化学键为 ,该物质属于 (填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(4)D是同周期简单阳离子中离子半径最 的元素。
(5)F的单质在反应中常作 剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
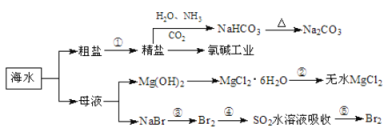
下列有关说法正确的是
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应为:O2+2H2O+4e-=4OH-
C.通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)根据如图所示情况,判断下列说法中正确的是 。
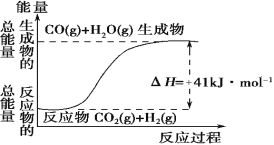
A.其热化学方程式为:CO(g) + H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g) = 2NO(g) △H1
2H2(g) + O2(g) = 2H2O(g) △H2
N2(g) + 3H2(g) = 2NH3(g) △H3
利用上述三个反应,计算4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) △H4 的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为 。
②已知反应2HI(g)![]() H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g) + I2(g)的△H= + 11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
③Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
根据上述实验结果,该反应的平衡常数K的计算式为: 。上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 (以K和k正表示)。若k正=0.0027min﹣1,在t=40min时,v正= min﹣1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O![]() Fe(OH)3↓+3 H+
Fe(OH)3↓+3 H+
B.澄清石灰水与稀盐酸反应Ca(OH)2 + 2 H+ ═ Ca2+ + 2 H2O
C.稀硫酸除铁锈:Fe2O3 + 6 H+ == 2 Fe3+ + 3 H2O
D.硫酸和Ba(OH)2反应: Ba2+ + OH- + SO42- + H+ = BaSO4↓ + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com