
(10分)如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
(1)在A试管内发生反应的化学方程式是_____ ___。
(2)B装置的作用是___________________ _________。
(3)在双球干燥管内发生反应的化学方程式为________________。
(4)双球干燥管内观察到的实验现象是______________________;上述实验现象说明:________ _______________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:
______________________________________。

:(1)2NaHCO3Na2CO3+H2O+CO2↑ (2)吸收气体中的水蒸气(干燥CO2)
(3)2Na2O2+2CO2===2Na2CO3+O2
(4)淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈Na2O2能与CO2反应,生成白色粉末状物质和O2
(5)点燃的蚊香逐渐熄灭
【解析】(1)碳酸氢钠受热易分解,方程式为2NaHCO3 Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
(2)浓硫酸具有吸水性,能吸收CO2气体中的水蒸气。
(3)过氧化钠能吸收碳酸氢钠分解生成的CO2,所以方程式为2Na2O2+2CO2===2Na2CO3+O2。
(4)过氧化钠吸收CO2,生成碳酸钠和氧气,所以实验现象是淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈。
(5)氧化钠和CO2反应得不到氧气,所以选项是点燃的蚊香逐渐熄灭。


科目:高中化学 来源: 题型:阅读理解
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 回答酸碱滴定实验中的下列问题:
回答酸碱滴定实验中的下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学小组采用如图装置,以冰醋酸和异戊醇制备少量乙酸异戊酯(俗称:香蕉水)。
已知:CH3COOH+HOCH2CH2CH(CH3)2 CH3COOCH2CH2CH(CH3)2+H2O
|
| 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2℃ | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78℃ | 140 | 难溶于水 |
实验步骤:
(1)制备粗品
在50mL干燥的 中(填仪器名称)加入10mL(8.1g , 0.092mol)异戊醇和10mL(10.5g , 0.175mol)冰醋酸,振摇下缓缓加入2.5mL浓硫酸并使其混合均匀,再投入几块碎瓷片,装上冷凝管,冷却水从_________口进入,控制温度100℃左右,加热回流至锥形瓶中液体无明显增加为止。
A中碎瓷片的作用是
锥形瓶中的液体主要是 ,采用边反应边将其蒸出的方法的目的是 。
(2)制备精品
①反应结束后,冷却反应物至室温。将装置A中的反应混合物倒入分液漏斗中,用少量饱和食盐水荡洗反应瓶,一起并入分液漏斗。用饱和食盐水代替蒸馏水的优点是 。
②振摇分液漏斗,静置分层后分去水层。有机层先用25 mL 10% 碳酸钠水溶液洗涤除去 杂质 ,再用水洗涤两次。分尽水层后将酯层转入干燥的锥形瓶中,用 (填写选项)干燥0.5h。
a.五氧化二磷 b.碱石灰 c.无水硫酸镁 d.生石灰
③将干燥后的液体过滤到装置A中,加热蒸馏收集 ℃的馏分,称重,产物重8.4g,则该实验的产率为 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南安阳一中高二月考(奥数班)化学试卷(带解析) 题型:实验题
盐酸或硫酸和氢氧化钠溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明氢氧化钠溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题。
(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是_________ ,原因是___________。
(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的氢氧化钠溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1 mol·L-1 | 0.05 mol·L-1 | 3.5 |
| 2 | 0.1 mol·L-1 | 0.1 mol·L-1 | x |
| 3 | 0.2 mol·L-1 | 0.2 mol·L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源:2014届河南安阳一中高二月考(奥数班)化学试卷(解析版) 题型:实验题
盐酸或硫酸和氢氧化钠溶液的中和反应没有明显的现象。某学习兴趣小组的同学为了证明氢氧化钠溶液与盐酸或硫酸发生了反应,从中和反应的热效应出发,设计了下面几种实验方案。请回答有关问题。
(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上。开始时使右端U形管两端红墨水相平。实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是_________ ,原因是___________。
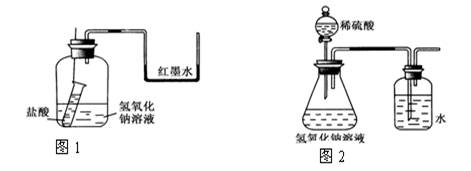
(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生。如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应。该小组同学将不同浓度的氢氧化钠溶液和盐酸各10 mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
|
编号 |
盐酸 |
氢氧化钠 |
△t/℃ |
|
1 |
0.1 mol·L-1 |
0.05 mol·L-1 |
3.5 |
|
2 |
0.1 mol·L-1 |
0.1 mol·L-1 |
x |
|
3 |
0.2 mol·L-1 |
0.2 mol·L-1 |
14 |
则x=____________。
(3)方案三:该小组还设计了如图2示装置来证明氢氧化钠溶液确实与稀硫酸发生了反应。他们认为若洗气瓶中导管口有气泡冒出,则说明该反应放出热量,从而证明发生了反应。
①实验时,打开分液漏斗活塞,发现导管流出液体不畅,原因可能是______________
②从原理上讲,该实验设计的不合理之处为__________________________________。
请你在此实验装置的基础上提出修改方案__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com