
【题目】如图,a、b、d均为石墨电极,c为Mg电极,通电进行电解(电解液足量),下列说法正确的是
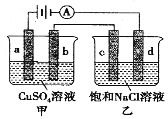
A.向甲中加入适量Cu(OH)2,溶液组成可以恢复
B.电解一段时间,乙溶液中会产生白色沉淀
C.当b极增重3.2g时,d极产生的气体体积为1.12L
D.甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. ![]() 的NH4NO3溶液中氮原子数小于0.2NA
的NH4NO3溶液中氮原子数小于0.2NA
B. 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH-
C. 在O2参加的反应中,1mol O2作氧化剂时得到的电子数一定是4NA
D. 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充分反应时转移的电子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是中学化学中常见的六中有机物,它们的转化关系如图1所示(部分物质已省略).其中A是一种生物生长调节剂,E具有水果香味,F是一种可制成多种包装材料的高分子化合物。

(1)C的结构简式为____。
(2)D分子中官能团的名称____,证明该官能团具有酸性的方法为 。
(3)写出图1转化过程中的化学反应方程式① ____;② ;⑤ 。
(4)写出图1有机反应类型① ______ ;② ______。
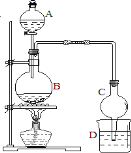
(5) 某课外小组设计的实验室制取乙酸乙酯的装置如图2所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
①浓硫酸的作用是______;
②若用同位素 18O标记乙醇中的氧原子,则CH 3CH 2 18OH与乙酸生成乙酸乙酯的化学方程式为____。
③球形干燥管C的作用是 。
④反应结束后D中的现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是( )
A. 蒸馏实验时,在烧瓶内加几粒沸石以防止暴沸
B. 制蒸馏水时,应使温度计水银球靠近蒸馆烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 进行过滤时,玻璃棒的末端应轻轻靠在三层的滤纸上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2SO2+O22SO3 , 下列说法不正确的是( )
A.使用合适的催化剂可以加大反应速率
B.通入过量的O2可以使SO2转化率达到100%
C.升高温度可以增大反应速率
D.增大O2浓度可以增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳合金在现代建筑中占有十分重要的地位。
(1)基态Fe3+的M能层上电子排布式为_______,铁元素可形成多种配合物,如K3[Fe(CN)6]和Fe(CO)5,则这两种配合物所涉及的元素中,第一电离能由大到小的顺序为________,电负性最大的是_______。
(2)三聚氰胺(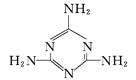 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为_______。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________________。
(3)已知常温下草酸(HOOC—COOH)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5×10-4,试从结构上解释Ka1、Ka2数值上的差异__________________。
(4)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点________(填“高于”、“低于”或“无法判断”)金刚石的熔点。
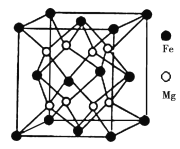
(5)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____________(不必化简,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量Cr2O72-和CrO42-,它们会对人类及生态系统产生很大伤害。
已知:i. 2CrO42-(黄色)+ 2H+ ![]() Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O ![]() [Cr(OH)4]- (亮绿色) + H+
[Cr(OH)4]- (亮绿色) + H+
(1) 含铬工业废水的一种处理流程如下:
![]()
① i. 若在转化一步中调节溶液的pH=2,则溶液显_______色。
ii. 能说明转化一步反应达平衡状态的是_______(填字母序号)。
a.Cr2O72-和CrO42-的浓度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的颜色不变 d.溶液的pH不变
② 步骤②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐渐滴加NaOH溶液。当pH=4.6时,开始出现灰绿色沉淀,随着pH的升高,沉淀量增多。当pH≥13时,沉淀逐渐消失,溶液变为亮绿色。
i. 请解释溶液逐渐变为亮绿色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,铬元素以_______形式存在(填离子符号)。
(2) 用Fe做电极电解含Cr2O72-的酸性工业废水,可以直接除去铬。随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
① 结合上述工业流程分析用Fe做电极的原因:_______。
② 结合电极反应式解释在阴极附近溶液pH升高的原因:_______。
③ 溶液中同时生成的沉淀可能还有_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:

注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。

则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com