
(8分)铜在常温下能被稀HNO3溶解:3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
⑴ 请将上述反应改写成离子方程式:_____________________。
⑵ 上述反应中氧化剂是 ,没有参加氧化还原反应的硝酸占总硝酸的比例_____。
(3)取1.92gCu与一定量浓HNO3恰好完全反应,生成气体颜色由红棕色逐渐变成无色,共得到标准状况下气体1.12L,则参加反应的硝酸为_____________mol。
⑴ 3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O ⑵ HNO3 3/4 (3)0.11
解析:(1)考查离子方程式的书写。在改写离子方程式时,关键是找准哪些物质可以用离子符合来表示,哪些可以用化学式来表示。只有既能溶于水,又能完全电离的物质才能用离子来表示,其他的均用化学式表示。
(2)由方程式可知8mol硝酸参加反应其中只有2mol硝酸被还要,其氮元素的化合价由+5价降低到+2价,所以没有参加氧化还原反应的硝酸占总硝酸的比例3/4。
(3)生成气体颜色由红棕色逐渐变成无色,说明气体是NO和NO2的混合气体,其物质的量是![]() =0.05mol,根据氮元素守恒可知被还原的硝酸的物质的量就是0.05mol。1.92gCu被氧化生成Cu(NO3)2,其物质的量是
=0.05mol,根据氮元素守恒可知被还原的硝酸的物质的量就是0.05mol。1.92gCu被氧化生成Cu(NO3)2,其物质的量是![]() mol。同样根据氮元素守恒可知没有被还原的硝酸的物质的量就是0.03mol×2=0.06mol,参加反应的硝酸为0.06mol+0.05mol=0.11mol。
mol。同样根据氮元素守恒可知没有被还原的硝酸的物质的量就是0.03mol×2=0.06mol,参加反应的硝酸为0.06mol+0.05mol=0.11mol。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
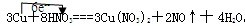
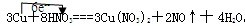
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东济南平阴一中高一上学期期末检测化学试卷(带解析) 题型:填空题
(8分)铜在常温下能被稀HNO3溶解:3Cu+8HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O
⑴ 请将上述反应改写成离子方程式:_____________________。
⑵ 上述反应中氧化剂是 ,没有参加氧化还原反应的硝酸占总硝酸的比例_____。
(3)取1.92gCu与一定量浓HNO3恰好完全反应,生成气体颜色由红棕色逐渐变成无色,共得到标准状况下气体1.12L,则参加反应的硝酸为_____________mol。
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省天水市高一第一学期段考化学试卷 题型:填空题
已知铜在常温下能被稀HNO3溶解:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
⑴请将上述反应改写成离子方程式:_________________________________(2分)
⑵上述反应中氧化剂是______,氧化产物是______,在反应的硝酸中,没有参加氧化还原反应的硝酸占总硝酸的__ ____(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com