解:(1)题中H→A为工业冶炼金属铝,A→J为铝热反应,为推断题的突破口,依次可知C→E→H→A→J的转化是中学化学中常见反应,为AlO
2-→Al(OH)
3→Al
2O
3→Al→Fe之间的转化,该原电池是铝做负极,铁做正极,电解质溶液为NaOH,可以推知:A为Al,C为NaAlO,E为Al(OH)
3,H为Al
2O
3,J为Fe,M为FeS,原电池中,Al做负极被氧化,在碱性溶液中生成AlO
2-,电极反应式为:Al+4OH
--3e
-=AlO
2-+2H
2O,故答案为:Al+4OH
--3e
-=AlO
2-+2H
2O;
(2)溶液C为NaAlO
2,根据溶液呈电中性,即c(AlO
2-)+c(OH
-)=c(Na
+)+c(H
+)可知:c(Na
+)-c(AlO
2-)=c(OH
-)-c(H
+)=10
-2-10
-12 mol/L,故答案为:10
-2-10
-12 mol/L或c(OH
-)-c(H
+);
(3)金属A的氯化物为AlCl
3,为共价化合物在熔融状态下不导电,故答案为:否;因为A的氯化物熔沸点低,据此判断它的晶体为分子晶体,在熔融态时不电离,不能被电解;
(4)原电池正极生成H
2,即D为H
2,则G为氢化物,由G→I→K的转化可知该氢化物中存在变价非金属元素,应为N元素,故G为NH
3,I为NO,K为NO
2,L为HNO
3,反应②为工业合成氨的重要反应,反应为:4NH
3+5O
2 
4NO+6H
2O,
故答案为:4NH
3+5O
2 
4NO+6H
2O
(5)反应A→J为铝热反应,反应为:Fe
2O
3+2Al

2Fe+Al
2O
3 故答案为:Fe
2O
3+2Al

2Fe+Al
2O
3 (6)①AlCl
3水溶液与NaHCO
3溶液反应相互促进的水解,反应为Al
3++3HCO
3-=Al(OH)
3↓+3CO
2↑,该反应为泡沫灭火器的反应原理,故答案为:Al
3++3HCO
3-=Al(OH)
3↓+3CO
2↑;
②含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色,说明盐中含有铝元素和钾元素,为明矾,俗称为明矾或白矾;
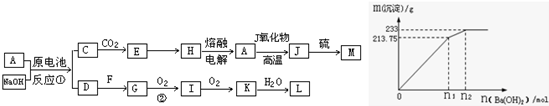
根据反应计算:
Ba
2++SO
42-═BaSO
4
1mol 233g
n 233g
则n=1mol,根据SO
42-离子的守恒可知500mLKAl(SO
4)
2的溶液中含有溶质的物质的量为0.5mol,
故浓度为:
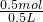
=1mol/L,故答案为:明矾或白矾;1mol/L.
分析:(1)题中C→E→H→A→J的转化是中学化学中常见反应,H→A为工业冶炼金属铝,A→J为铝热反应,故应为AlO
2-→Al(OH)
3→Al
2O
3→Al→Fe的反应,该原电池是铝做负极,铁做正极,电解质溶液为NaOH,负极上发生的反应为:
Al+4OH
--3e
-=AlO
2-+2H
2O;
(2)溶液C为NaAlO
2,根据溶液呈电中性,即c(AlO
2-)+c(OH
-)=c(Na
+)+c(H
+),进行判断离子关系;
(3)根据AlCl
3为共价化合物在熔融状态下不导电进行分析;
(4)反应②为工业合成氨的重要反应,反应为:4NH
3+5O
2 
4NO+6H
2O;
(5)反应A→J为铝热反应,反应为:Fe
2O
3+2Al

2Fe+Al
2O
3;
(6)①根据弱酸的阴离子和弱碱的阳离子发生相互促进的水解来书写离子方程式;
②含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色,说明盐中含有铝元素和钾元素,为明矾,根据图象判断反应的物质的量的关系,以此计算.
点评:本题考查元素化合物推断,同时考查电化学、晶体类型的判断、盐类的水解等知识,具有较高的综合度,本题具有一定的难度.


 4NO+6H2O,
4NO+6H2O, 4NO+6H2O
4NO+6H2O  2Fe+Al2O3 故答案为:Fe2O3+2Al
2Fe+Al2O3 故答案为:Fe2O3+2Al 2Fe+Al2O3
2Fe+Al2O3 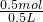 =1mol/L,故答案为:明矾或白矾;1mol/L.
=1mol/L,故答案为:明矾或白矾;1mol/L. 4NO+6H2O;
4NO+6H2O;  2Fe+Al2O3;
2Fe+Al2O3;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有