
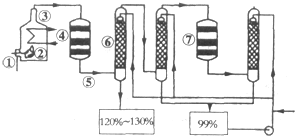
 如图是现今常规生产发烟硫酸和硫酸的流程图:
如图是现今常规生产发烟硫酸和硫酸的流程图:| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |
| 催化剂 |
| 高温 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| A、104g | B、90g |
| C、92g | D、88g |
查看答案和解析>>
科目:高中化学 来源: 题型:
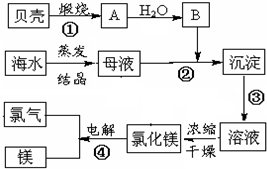 海水中含有丰富的化学元素,如图是某化工厂利用海水生产镁的流程简图,请回答:
海水中含有丰富的化学元素,如图是某化工厂利用海水生产镁的流程简图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
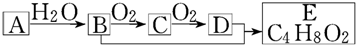
| A、A→B属于加成反应 | |||
| B、B、D均能与金属钠反应 | |||
| C、物质C的结构简式为CH3CHO | |||
D、生成E的化学方程式为:CH3CH2OH+CH3COOH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
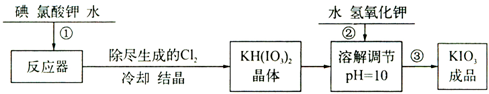
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100g水 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| PH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
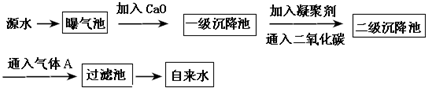
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用明矾净化饮用水 |
| B、清晨林间透过缕缕阳光 |
| C、三氯化铁溶液中加入NaOH出现红褐色沉淀 |
| D、向煮熟的豆浆中加入石膏或卤水以生产豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烷和丁烷均属于烷烃 |
| B、两者分子中均含有碳碳双键 |
| C、丙烷和丁烷燃烧均是放热反应 |
| D、丙烷和丁烷充分燃烧均生成二氧化碳和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com