
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
(1)0.006 酸性 (2)② 不能 该反应只能说明I2的还原性比Br2强
(3)BrO3-> IO3-> Br2 > I2 BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O
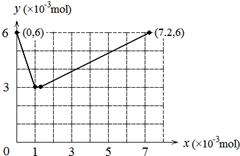
(4) 
解析试题分析:(1)I-被氧化成I2,0.006mol I-被氧化时转移电子数为0.006mol。硫酸表现出的是酸性作用。
(2)ii是KBrO3氧化I2,所以②反应符合。该反应只能说明I2的还原性比Br2强,不能说明碘的非金属性强于溴。
(3)根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性BrO3-> IO3-> Br2 > I2。KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O。
(4)整个过程发生如下两个反应:①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ②2BrO3-+ I2 = 2IO3-+ Br2,当
KBrO3加入1×10-3mol时I-全部被氧化成I2,当KBrO3加入7×10-3mol时I2全部被氧化成IO3-。所以图像为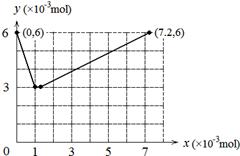 。
。
考点:氧化还原反应
点评:本题主要根据实验的现象来确定反应。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com