
【题目】下列属于酸性食物的是
A. 苹果 B. 西瓜 C. 梨 D. 鸡肉
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是:
A. a = b
B. 混合溶液的pH = 7
C. 混合溶液中,c(H+) =![]() mol/L
mol/L
D. 混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H7N9型禽流感是一种新型禽流感,浙江自2015年入秋以来,已累计报告人感染H7N9禽流感4例。研究表明,该病毒对热敏感,煮沸2分钟以上即可失去活性,许多常用消毒药物如:高锰酸钾、漂白粉、氯气等,也都可以将该病毒杀灭。
(1)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是___________;过一会儿,溶液颜色逐渐褪去,起作用的微粒是______________。
请写出氯气与水反应的离子方程式_____________________。
(2)工业上制取漂白粉的反应方程式为:__________________。
(3)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4 + 16HCl ![]() 2MnCl2 + 2KCl + 8H2O + 5Cl2↑,该反应中氧化剂为____________。
2MnCl2 + 2KCl + 8H2O + 5Cl2↑,该反应中氧化剂为____________。
(4)向漂白粉清液中滴加碳酸钠溶液,有白色沉淀生成,写出发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4![]() 2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. 升高温度该反应的平衡常数K减小
B. 20~40 s 内,v(N2O4)=0.002 mol/L .s
C. 反应达平衡时,吸收的热量为0.30 Q kJ/mol
D. 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的说法正确的是:
A.已知C(石墨,s) ![]() C(金刚石,s) △H>0,说明金刚石比石墨稳定
C(金刚石,s) △H>0,说明金刚石比石墨稳定
B.已知H+(aq) + OH-(aq) = H2O(l) △H= -57.4kJ/mol,则含20.0gNaOH的稀溶液与稀醋酸完全中和,放出热量小于28.7kJ
C.已知甲烷的燃烧热为890.3kJ/mol,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g) + 2O2 (g) = CO2(g) + 2H2O(g) △H= -890.3kJ/mol
D.将0.5molN2和1.5molH2置于密闭容器中充分反应达到平衡时,放出热19.3kJ的热量,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ/mol
2NH3(g) △H= -38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
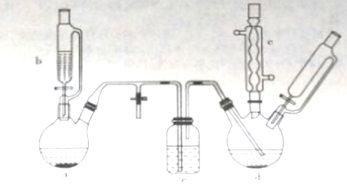
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下三组混合物:①煤油和硫酸钾溶液 ②42%的乙醇溶液 ⑧氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com