
【题目】我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾.检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(1)该反应中氧化剂是(填化学式).
(2)用双线桥表示该反应电子转移的方向和数目.KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(3)如果反应中转移0.2mol电子,则生成I2的物质的量为 .
(4)利用上述反应检验食盐中是否加碘,所需试剂是(填选项序号). ①碘水 KI溶液 淀粉溶液 稀硫酸 四氯化碳.
【答案】
(1)KIO3
(2)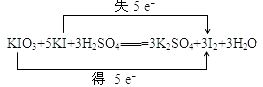
(3)0.12moL
(4)②③④
【解析】解:(1)KIO3中I元素的化合价降低,则KIO3为氧化剂,故答案为:KIO3;(2)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,化合价升高值=化合价降低值=转移电子数=5e﹣ , 用双线桥表示该反应电子转移的方向和数目为: 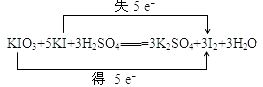 ,故答案为:
,故答案为: 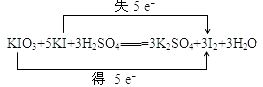 ;(3)在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.2mol电子,则生成I2的物质的量为0.2mol×
;(3)在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.2mol电子,则生成I2的物质的量为0.2mol× ![]() =0.12moL,故答案为:0.12mol;(4)食盐中加碘加的是碘酸钾,可以将碘酸根离子转化为碘单质,需要一种还原剂(碘化钾)来实现,再根据碘单质遇到淀粉显示蓝色来检验,在酸性环境下,碘酸根离子和碘离子之间反应生成碘单质,所以选择的试剂有:KI溶液、淀粉溶液、稀硫酸,故答案为:②③④.
=0.12moL,故答案为:0.12mol;(4)食盐中加碘加的是碘酸钾,可以将碘酸根离子转化为碘单质,需要一种还原剂(碘化钾)来实现,再根据碘单质遇到淀粉显示蓝色来检验,在酸性环境下,碘酸根离子和碘离子之间反应生成碘单质,所以选择的试剂有:KI溶液、淀粉溶液、稀硫酸,故答案为:②③④.
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由﹣1价升高为0,该反应中转移5e﹣ , 结合淀粉遇碘单质变蓝来解答.


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.标准状况下,1mol任何物质体积均为22.4L
C.3.01×1023个SO2分子的质量为32g
D.CH4的摩尔质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有希望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,1 molH2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2放出890.3 kJ的热量。下列热化学方程式书写正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H=+890.3kJ·mol-1
H=+890.3kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H= - 890.3 kJ·mol-1
H= - 890.3 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) ![]() H=890.3 kJ
H=890.3 kJ
D. 2H2(g)+O2(g)=2H2O(l) ![]() H=-285.8 kJ·mol-1
H=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的一个原子失去两个电子被两个Y元素的原子获得,从而二者形成稳定的化合物Z,下列有关Z的推断不正确的是( )
A. Z是离子化合物 B. Z的化学式是XY2
C. Z的化学式是X2Y D. Z的熔点较高,熔融状态或溶于水都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示配制一定物质的量浓度溶液的几个关键实验步骤和操作,现欲配制250mL 0.100molL﹣1 Na2CO3溶液,回答下列问题: 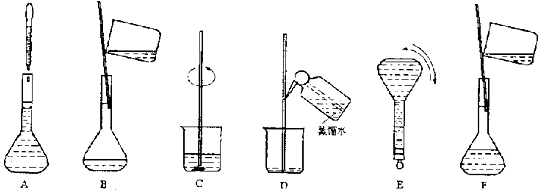
(1)将上述实验步骤A﹣F按实验过程先后次序排列 .
(2)步骤B通常称为转移,玻璃棒的作用是;步骤A通常称为 , 此时应注意与相切,如果俯视刻度线,配制的浓度(填偏大、偏小或无影响);步骤结束后发现液面低于刻度线,则配制的浓度(填偏大、偏小或无影响).
(3)下列关于容量瓶使用的说法正确的是
A.使用前须干燥
B.使用前先检查瓶塞不漏水
C.配好的溶液可以贮存在容量瓶中
D.热溶液须冷却至室温才能转移入容量瓶
E.容量瓶用于准确配制任意体积的一定物质的量浓度的溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是____________。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是____________________,弊是________________________。聚合硫酸铁溶液中SO42与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42与Fe3+物质的量之比。
(4)测定时所需的试剂____________。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定____________和____________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作____________(按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com