
(7分)向10ml0.1mol/l的Na[Al(OH)4]溶液中滴加0.1mol/l的HCl溶液,生成沉淀的量与加入的盐酸体积的关系如图
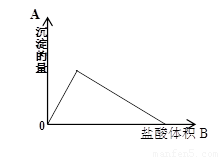
(1)写出OA段的离子方程式
(2)写出AB段的化学方程式
(3)OB段反应共消耗 ml盐酸溶液;
此过程中生成沉淀最多时,沉淀物质的量是 mol,此时消耗的盐酸是 ml
(1)[Al(OH)4]-+ H+ = Al(OH)3↓+H2O(2分)
(2)Al(OH)3 + 3HCl = AlCl3+ 3H2O (2分)
(3)40 0.001 10(每空1分)
【解析】向Na[Al(OH)4]溶液中滴加HCl溶液会生成氢氧化铝沉淀,离子方程式为[Al(OH)4]-+ H+ = Al(OH)3↓+H2O。当沉淀达到最大值时,若继续加入盐酸,则盐酸会溶解氢氧化铝而使溶液澄清,方程式为Al(OH)3 + 3HCl = AlCl3+ 3H2O。Na[Al(OH)4]是0.001mol,根据方程式可计算出最终消耗当盐酸体积是40ml。根据原子守恒可得出沉淀物质的量是0.001mol,此时消耗当盐酸是10ml。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com