
| A. | 相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3•H2O; c(NH4+)由大到小的顺序是:①>②>③>④ | |
| B. | 某溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 常温下,若0.1mol/L NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(Y2-)>c(H+)>c (H2Y) |
分析 A、物质的量相等的这几种溶液中,NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),铵根离子水解程度较小,所以要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
B、常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
C、物质的量浓度相等的H2S 和NaHS 混合溶液中存在物料守恒;
D、若NaHY溶液的pH=4,说明HY-电离程度大于HY-水解程度.
解答 解:A、NH3•H2O溶液中c(NH4+)小于铵盐的c(NH4+),所以一水合氨溶液中铵根离子浓度最小;③②中铵根离子系数都是1,醋酸根离子促进铵根离子水解,①中铵根离子系数都是2,其溶液中铵根离子浓度大于其余溶液中铵根离子浓度,则溶液中铵根离子浓度从小到大顺序是:①>②>③>④,故A正确;
B、解:A.常温时,某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=a,如为碱溶液,则pH=14-a,故B错误;
C、物质的量浓度相等的H2S 和NaHS 混合溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S),故C错误;
D、若NaHY溶液的pH=4,说明HY-电离程度大于HY-水解程度,则有c(Y2-)>c(H2Y),因溶液中还存在水的电离,则c(H+)>c(Y2-),故c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y),故D错误;
故选A.
点评 本题考查离子浓度的大小比较、盐的水解原理的应用知识,题目难度中等,注意从溶液的电荷守恒和物料守恒的角度分析.


科目:高中化学 来源: 题型:解答题
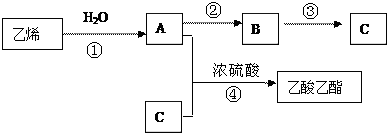
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;c(NH4+)由大到小的顺序是:②>①>③>④ | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)+c(H+)=c(S2-)+c (HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,Ksp减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、Cl-、SiO32- | B. | Fe3+、Ba2+、I-、NO3- | ||
| C. | NH4+、K+、S2-、SO32- | D. | H+、Ca2+、F-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

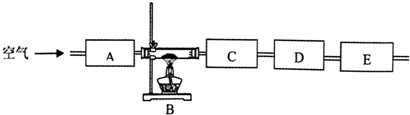
| 仪器 编号 | 药品 | 目的 |
| A | 碱石灰 | |
| B | 绿色固体 | |
| C | ||
| D | ||
| E | 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
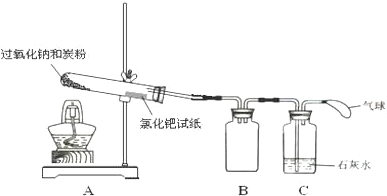
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
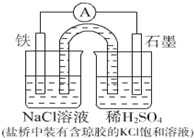
| A. | Fe作正极,发生氧化反应 | |
| B. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| C. | 正极反应:2H++2e-=H2↑ | |
| D. | 工作一段时间后,NaCl溶液中c(Na+ )增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否出现红色 | |
| D. | 加入CCl4振荡后,取上层清液,滴加入AgNO3溶液,观察是否有AgCl沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com