
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1;途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1;2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1;2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
II、利用如图所示装置测定中和热的实验步骤如下:
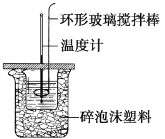
①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.1 | 20.1 | 24.2 |
4 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
【答案】N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣640kJ/mol 408 等于 确保盐酸被完全中和 51.8 H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响中和热的测定
【解析】
I、(1)0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量,则1mol液态肼和足量液态H2O2反应,放出热量为640kJ/mol,据此写出该热化学反方程式;
(2)根据盖斯定律求出N2H4(1)与H2O2(1)反应的△H,然后根据16g液态肼的物质的量(0.5mol)计算出反应放出的热量;
(3)根据盖斯定律,丙烷作为燃料不管是一步完成还是分三步完成,反应的热效应是一定的;
II、(1)NaOH溶液要稍过量,保证盐酸被完全中和;
(2)先计算出三次实验的温度变化的平均值;然后根据Q=cmt计算出0.025mol的水放出热量,根据中和热的定义,计算出生成1mol的水放出热量;
(3)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热。
I、(1)0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量,则1mol液态肼和足量液态H2O2反应,放出热量为640kJ/mol;热化学反方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣640kJ/mol;
故答案是:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣640kJ/mol;
(2)已知①H2O(l)═H2O(g);△H=+44kJ·mol﹣1;② N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=﹣640kJ/mol;根据盖斯定律:②-①×4可得:N2H4(1)+2H2O2(1)=N2(g)+4H2O(l)△H=﹣816kJ/mol;16g液态肼的物质的量为16g/32g/mol=0.5mol,则0.5mol液态肼燃烧生成氮气和液态水时,放出的热量是0.5mol×816kJ/mol=408 kJ;
故答案是:408;
(3)途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1;途径II:①C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1;②2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1;③2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)根据盖斯定律计算①+②×1/2+③×1/2,得到:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣(1/2c+1/2d-b)kJ·mol﹣1;根据盖斯定律,丙烷作为燃料不管是一步完成还是分三步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样;
故答案是:等于;
II、(1)为了确保盐酸被完全中和,所用NaOH溶液要稍过量;
故答案是:确保盐酸被完全中和;
(2)第1次实验盐酸和NaOH溶液起始平均温度为20℃,反应后温度为: 23.0℃,反应前后温度差为:3℃;第2次实验盐酸和NaOH溶液起始平均温度为20.1℃,反应后温度为: 23.2℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.2℃,反应后温度为: 23.4℃,反应前后温度差为: 3.2℃;50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液的质量和为100mL×1 g·cm3=100g;比热容c=4.18 J·g1·℃1,代入公式Q=cmt得到生成0.025mol的水放出热量Q=4.18 J·g1℃1×100g×(3℃+3.1℃+3.2℃)/3=1295.8J=1.2958 kJ;即生成0.025mol的水放出热量为1.2958 kJ,所以生成1mol的水放出热量为1.2958 kJ ×1mol/0.025mol=51.8 kJ ,即该实验测得的中和热ΔH=-51.8 kJ·mol1;
故答案是: -51.8;
(3)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测定中和热;
故答案是: H2SO4与Ba(OH)2反应生成BaSO4沉淀的生成热会影响中和热的测定。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】(1)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为_____。
(2)把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g;则原混合物中Na2CO3的物质的量为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。

(1)铜与稀硝酸反应的化学方程式为_________________。
(2)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨气把NO还原为氮气和水。该反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,每有5 mol N2生成,氧化产物与还原产物的物质的量之比为__________。
5N2+6H2O,每有5 mol N2生成,氧化产物与还原产物的物质的量之比为__________。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体通入水中,该气体与水反应的化学方程式为______________________________________________。
(4)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式__________。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是________________________、___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所列物质中,属于电解质的是__________(填序号,下同),属于非电解质的是________,属于强电解质的是__________,属于弱电解质的是________。
①CH3CH2OH ②CH3COOH ③熔融态KNO3 ④SO3 ⑤蔗糖 ⑥HClO ⑦NaHCO3 ⑧氨水 ⑨Cl2 ⑩BaSO4 Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备SnCl4,某化学小组的同学设计了如下实验装置进行制备。
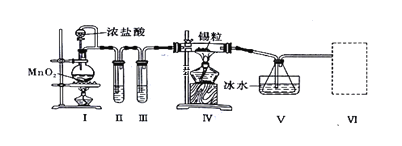
已知:①金属锡熔点为231℃,化学活泼性与铁相似;②SnCl4的沸点为114℃;③SnCl4易与水反应。
请根据上图装置回答:
(1)装置I中反应的离子方程式是________________________________________
(2)试管II中的试剂是________,试管III中的试剂是____________。
(3)装置V的作用是____________。
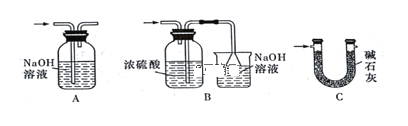
(4)裝置Ⅵ 最好选用下列装置中的________(填标号)。
(5)实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔是一种抗病毒药物,其分子结构如图,关于阿比朵尔说法不正确的是
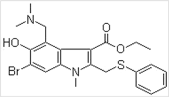
A.阿比朵尔分子式为 C22H24BrN2O3S
B.阿比朵尔能与碱或酸溶液反应生成盐
C.阿比朵尔一定条件下能发生取代、加成、氧化、还原反应
D.一定条件下,1 mol 阿比朵尔与足量 NaOH 溶液反应,最多可消耗 4 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com