
| A. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| B. | 60gSiO2中含有NA个SiO2分子 | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA | |
| D. | 1molFe与1mol氯气反应转移3NA个电子 |
分析 A、氨基不显电性;
B、SiO2是原子晶体;
C、Na2S和Na2O2的摩尔质量均为78g/mol;
D、1mol铁与1mol氯气反应时,铁过量.
解答 解:A、氨基不显电性,1mol氨基含9mol电子,则0.1mol氨基中含0.9mol电子,即0.9NA个,故A错误;
B、SiO2是原子晶体,结构中无二氧化硅分子,故B错误;
C、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,而Na2S和Na2O2均由2个阳离子和1个阴离子构成,故0.1mol混合物中含0.1阴离子,个数为0.1NA,故C正确;
D、1mol铁与1mol氯气反应,铁过量,故应根据氯气的物质的量来计算,而反应后氯元素变为-1价,故1mol氯气转移2mol电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
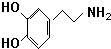 )是人体大脑中的一种有机物质叫做多巴胺.
)是人体大脑中的一种有机物质叫做多巴胺.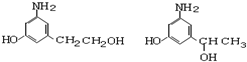 .
. 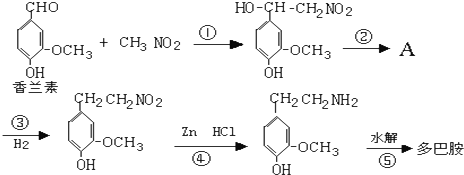
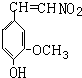 .
.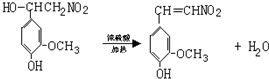 ,⑤:
,⑤: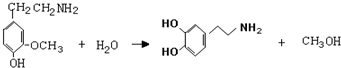 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 | |
| B. | 沉淀H为Al(OH)3、BaCO3的混合物 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在配制FeSO4溶液时常向其中加入一定量铁粉和稀硫酸 | |
| B. | 用广泛pH试纸测量得某溶液的pH=13 | |
| C. | 用碱式滴定管量取20.00mL0.1000mol/LKmnO4溶液 | |
| D. | 实验室可将铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜以节约药品、减少污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
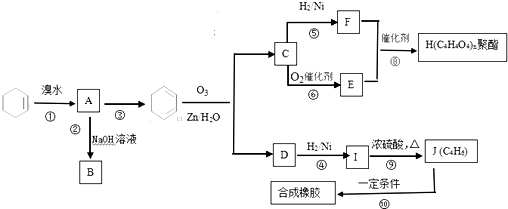
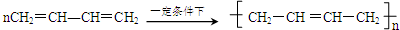 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
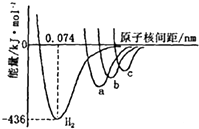 如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.
如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2形成过程的曲线是a(填“a”、“b”或“c”),理由是Cl、Br、I三种原子中,氯原子半径最小,形成分子的键长最短.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.
)为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.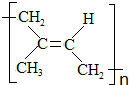 .
.

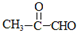 ;
; ;反应类型:酯化反应.
;反应类型:酯化反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com