
| A. | pH=1的溶液:Fe2+、Ca2+、I-、Br- | |
| B. | Ag+、I-、K+、NO3- | |
| C. | 0.1mol/L 的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、[Al(OH)4]-、NO3- |
分析 A.pH=1的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.银离子与碘离子反应生成碘化银;
C.硝酸钾在酸性条件下具有强氧化性,能够氧化亚铁离子;
D.与铝反应产生大量氢气的溶液中存在大量氢离子或氢氧根离子,[Al(OH)4]-与氢离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气.
解答 解:A.pH=1的溶液为酸性溶液,溶液中存在大量氢离子,Fe2+、Ca2+、I-、Br-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.Ag+、I-之间反应生成碘化银沉淀,在溶液中不能大量共存,故B错误;
C.KNO3、H+、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.与铝反应产生大量氢气的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,[Al(OH)4]-与氢离子反应,NO3-在酸性条件下具有强氧化性,与铝反应不会生成氢气,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将20mL pH均为1的盐酸和醋酸分别加水稀释至pH为3 | 醋酸的体积变化大 | 醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
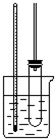 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应位于蒸馏烧瓶的支管口处 | |
| C. | 用萃取的方法分离碘水 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水发生反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 用氢氧化钠除去铝表面的氧化膜时产生气泡的反应2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | 将金属铁加入稀硫酸和硝酸钾混合溶液中,金属溶解:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3、Na2SO3、FeCl3溶液蒸干灼烧均得不到原溶质 | |
| B. | 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 | |
| C. | 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
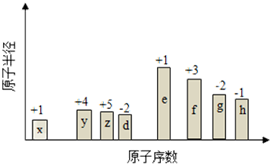 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: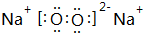 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.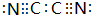 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com