
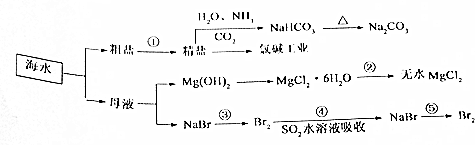
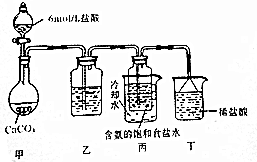
分析 (1)a.根据物质的性质结合元素化合价的变化判断;
b.NaHCO3溶液和Na2CO3溶液都可与石灰水反应生成碳酸钙沉淀;
c.氢氧化镁溶解度比氢氧化钙小,易生成沉淀;
d.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
(2)甲用于制备二氧化碳,用饱和碳酸氢钠溶液除去氯化氢气体,然后在丙中生成碳酸氢钠,丁为尾气吸收装置,用于吸收氨气;丙装置中采用冷却水的目的是降低碳酸氢钠的溶解度,便于碳酸氢钠析出,分离固体和液体,可用过滤的方法;过滤用到的仪器有玻璃棒、漏斗、烧杯等;在坩埚中灼烧碳酸氢钠生成碳酸钠;
(3)氯气通入溴化钠溶液是置换反应.SO2与溴水反应生成硫酸和溴化氢,反应中溴元素化合价由0价降低到-1价,被还原,溴单质为氧化剂,S元素化合价由+4价升高到+6价,被氧化,SO2为还原剂,根据得失电子守恒计算.
解答 解:(1)a.④中溴得电子化合价降低,所以溴元素被还原,故a错误;
b.NaHCO3溶液和Na2CO3溶液都可与石灰水反应生成碳酸钙沉淀,不能鉴别,故b错误;
c.氢氧化镁溶解度比氢氧化钙小,可用Ca(OH)2使母液中的Mg2+沉淀下来,故c正确;
d.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,故d错误;
故答案为:c;
(2)装置乙用于除去二氧化碳气体中的氯化氢,应用饱和碳酸氢钠溶液除杂,丙装置中往饱和食盐水中通入NH3和CO2时发生反应:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,采用冷却水的目的是通过降温,降低碳酸氢钠的溶解度,便于碳酸氢钠析出,碳酸氢钠为晶体,固液分离用过滤的方法,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯,在坩埚中灼烧碳酸氢钠生成碳酸钠和水,制得碳酸钠,
故答案为:饱和碳酸氢钠溶液;降低碳酸氢钠的溶解度,便于碳酸氢钠析出;过滤;玻璃棒、漏斗、烧杯;坩埚;
(3)氯气通入溴化钠溶液是置换反应,2Br-+Cl2=Br2+2Cl-,二氧化硫具有还原性通入溴水被氧化剂溴单质氧化为硫酸,反应的化学方程式SO2+Br2+2H2O=H2SO4+2HBr;
反应中S元素化合价由+4价升高到+6价,若有1mol SO2参加反应,则转移电子2mol,即2NA个,
故答案为:2Br-+Cl2=Br2+2Cl-;SO2+Br2+2H2O=H2SO4+2HBr;2NA.
点评 本题综合考查海水资源的利用,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理和方法,结合反应的相关方程式计算,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | O2 | C. | Cl2 | D. | 产生于阴极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com