
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 纯碱、小苏打、烧碱均属于碱 | B. | 盐酸、水泥合金都属于混合物 | ||
| C. | 水玻璃、玻璃、漂白粉都属于纯净物 | D. | 盐类物质一定含有金属阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Z2+2A2+═2A3++2Z-能够进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 反应①的离子方程式为:16H++10Z-+2XO4-═2X2++5Z2+8H2O | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
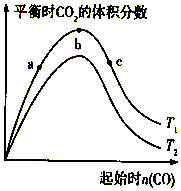 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 1mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用二氧化钛作催化剂使水快速分解的同时放出大量热 | |
| B. | 该过程涉及到的反应为氧化还原反应 | |
| C. | 该反应的原理是:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2+O2 | |
| D. | 每产生氢气44.8L,转移电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com