
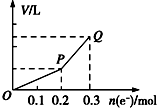
 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A. | 0.15 mol CuO | B. | 0.1 mol CuCO3 | ||
| C. | 0.075mol Cu(OH)2 | D. | 0.05 mol Cu2(OH)2CO3 |
分析 用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜单质,当铜离子完全析出时,继续电解,阴极上氢离子放电生成氢气,根据“析出什么加入什么”的原则加入物质即可.
解答 解:用惰性电极电解硫酸铜溶液时,先发生反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,当铜离子完全析出时,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,根据图象知,转移电子0.2mol时只有气体氧气生成,发生反应2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,实际上相当于析出氧化铜,根据氧化铜和转移电子之间的关系式得n(Cu)=$\frac{0.2mol}{2}$=0.1mol,所以相当于析出0.1molCuO;
继续电解发生的反应为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,实际上是电解水,根据水和转移电子之间的关系式得m(H2O)=$\frac{0.3-0.2}{4}$mol=0.25mol,所以电解水的物质的量是0.25mol,
根据“析出什么加入什么”的原则知,要使溶液恢复原状,应该加入0.1mol氧化铜和0.05mol水,
A.只加氧化铜不加水不能使溶液恢复原状,故A错误;
B.加入碳酸铜时,碳酸铜和稀硫酸反应生成硫酸铜和二氧化碳,所以相当于加入氧化铜,没有加入水,所以不能使溶液恢复原状,故B错误;
C.0.075mol Cu(OH)2相当于加入0.075molCuO和0.075molH2O,与析出物质的物质的量不同,所以不能恢复原状,故C错误;
D.0.05mol Cu2(OH)2CO3,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,根据原子守恒知,相当于加入0.1molCuO和0.05mol的水,所以能使溶液恢复原状,故D正确;
故选D.
点评 本题以电解原理为载体考查了物质间的反应,根据图象中转移电子确定析出物质,再结合“析出什么加入什么”的原则分析解答,易错选项是D,根据原子守恒将Cu2(OH)2CO3改写为2CuO.H2O.CO2来分析解答,题目难度中等.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
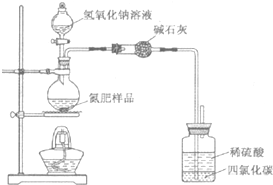 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽,蜡烛成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂 | |
| B. | 乙醇、金属钠和乙酸分别属于非电解质、非电解质和弱电解质 | |
| C. | Na2O2、Al2O3、C4H10分别属于碱性氧化物、两性氧化物和离子化合物 | |
| D. | 煤的气化、石油的分馏分别是化学变化、物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等pH值的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com