
| A. | 铁镁合金 | B. | 铁铜合金 | C. | 铁锌合金 | D. | 镁铝合金 |
分析 假设金属和酸反应后都生成+2价,n(H2)=$\frac{0.2g}{2g/mol}$=0.1mol,+2价金属和酸反应生成氢气时,金属和氢气的物质的量相等,则合金$\overline{M}$=$\frac{4g}{0.1mol}$=40g/mol,Al换算为+2价时其摩尔质量为18g/mol,和稀盐酸不反应的金属其摩尔质量无穷大,两种金属一种金属摩尔质量大于40g/mol一个小于40g/mol即可,据此分析解答.
解答 解:假设金属和酸反应后都生成+2价,n(H2)=$\frac{0.2g}{2g/mol}$=0.1mol,+2价金属和酸反应生成氢气时,金属和氢气的物质的量相等,则合金$\overline{M}$=$\frac{4g}{0.1mol}$=40g/mol,Al换算为+2价时其摩尔质量为18g/mol,和稀盐酸不反应的金属其摩尔质量无穷大,两种金属一种金属摩尔质量大于40g/mol一个小于40g/mol即可,
A.Fe的摩尔质量为56g/mol、Mg的摩尔质量为24g/mol,符合条件,故A正确;
B.Fe的摩尔质量为56g/mol、Cu的摩尔质量无穷大,都大于40g/mol,不符合条件,故B错误;
C.Fe的摩尔质量为56g/mol、Zn的摩尔质量为65g/mol,都大于40g/mol,不符合条件,故C错误;
D.Mg的摩尔质量是24g/mol、Al(+2)的摩尔质量是18g/mol,都小于40g/mol,不符合条件,故D错误;
故选A.
点评 本题考查混合物有关计算,侧重考查学生分析计算能力,采用平均摩尔质量法分析解答即可,注意Cu、Al金属摩尔质量的处理方法,为易错点.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
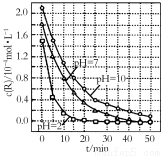
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越 强,R的降解速率越小
强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 除去CO2中的SO2:SO2+CO32-═CO2↑+SO32- | |
| C. | 0.01 mol SO2气体通入10 mL 1 mol/L的NaOH溶液中:SO2+OH-═HSO3- | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | SO2 | C. | CO2 | D. | C12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
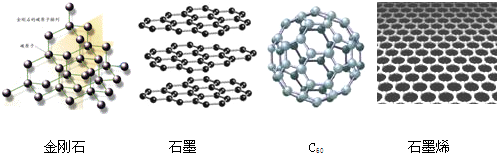
| A. | 金刚石和石墨烯中碳原子的杂化方式不同 | |
| B. | 金刚石、石墨、C60 和石墨烯的关系:互为同素异形体 | |
| C. | 这四种物质完全燃烧后的产物都是CO2 | |
| D. | 石墨与C60的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 聚乙烯不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 丙烯与水加成反应的产物存在同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com