
用黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是 ( )。
| 选项 | 实验 | 现象 | 解释或结论 |
| A | 加入FeCl3固体 | 溶液变成红褐色 | FeCl3的 |
| B | 加入等体积水 | 溶液颜色变浅 | c(Fe3+)变小 |
| C | 加入足量Fe粉 | 溶液颜色变成浅绿色 | 2Fe3++Fe===3Fe2+ |
| D | 将FeCl3溶液微热 | 溶液变成红褐色 | 水解反应ΔH>0 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
已知下列反应:Co2O3+6HCl(浓)===2CoCl2+Cl2↑+3H2O(Ⅰ);5Cl2+I2+6H2O===10HCl+2HIO3(Ⅱ)。下列说法正确的是 ( )。
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.还原性 :CoCl2>HCl>I2
:CoCl2>HCl>I2
D.氧化性:Co2O3>Cl2>HIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g)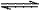 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为O.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为O.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度;
(2) B的转化率;
(3) x的值。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.石油裂解、煤的气化、海水制镁等过程中都包含化学变化
B.可通过电解熔融MgCl2来制取金属镁,故也能通过电解熔融AlCl3来制取
铝
C.铝热剂、盐酸、水玻璃、双氧水、明矾均为混合物
D.Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化 合物
合物
查看答案和解析>>
科目:高中化学 来源: 题型:
取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式:___________________________________________________,
反应后得到的溶液呈________色。用此溶液分别做如下实验:
(1)取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为_____________________________________________
________________________________________________________________,此反应属于________(填反应类型)。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈________色,即制得Fe(OH)3胶体。
(3)取另一只小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到________烧杯中的液体产生丁达尔效应。这个实验可以用来区别_______________________________。
(4)用Fe(OH)3胶体进行下列实验:
①将其装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明____________________________________________
_________________________________________________________________,这种现象称为________。
②向其中加入饱和(NH4)2SO4溶液发生的现象是________________,原因是________________ _____________________________________________
_____________________________________________ ______________________________________________________________________,
______________________________________________________________________,
③向其中滴入过量稀硫酸,现象是________________,其原因是___________ _________________________________________________________________。
④提纯此分散系常用的方法是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是____________________________________________________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比, 途径Ⅱ有明显的两个优点是_________________________________________________________、
途径Ⅱ有明显的两个优点是_________________________________________________________、
_________________________________________________________________。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行________次。
(6)若测定结果x值偏高,可能的原因是______________________________(填字母编号)。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数 ②原子总数 ③分子总数 ④物质的总能量 ⑤物质的总质量
A.①②⑤ B. ①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的说法中,错误的是( )
A.元素周期表是元素按原子序数从小到大从左到右排列而成的
B.主族元素原子的电子层数等于其所在周期的周期序数
C.四、五、六周期中都含有18种元素,其中Ⅷ族中所含元素种类最多
D.元素周期表中有18列、16个族,且第二列中无非金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com