
(11分)下图是一个化学过程的示意图。

(1)请回答图中甲池是______装置,其中OH-移向________极(填“CH3OH”或“O2”)
(2)写出通入CH3OH的电极的电极反应式_________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_________极(填“A”或“B”),并写出此电极反应的电极反应式____________。
(4)乙池中反应的离子方程式为____________。
(5)当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是________(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_______(填序号).
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(1) 原电池 CH3OH
(2) CH3OH-6e-+8OH- === CO32-+6H2O
(3) A 4OH--4e- === O2↑+2H2O
(4)4Ag+ + 2H2O = 4Ag + O2↑ + 4H+
(5) 1 BD
【解析】
试题分析:(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,故答案为:原电池;CH3OH;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上氢氧根离子放电导致电极附近氢离子浓度大于氢氧根离子浓度,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4OH--4e-=O2↑+2H2O;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加5.40g时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+;
432 4mol
5.40g 0.5xmol
x=0.1,则溶液的pH=1;
阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出5.40g时转移电子是0.05mol,
A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;
B、电解硫酸铜溶液时,阴极上析出1.60g铜需要转移电子0.05mol,故正确;
C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;
D、电解硝酸银溶液时,阴极上析出1.60g银需要转移电子0.0148mol<0.05mol,故正确;
故选BD。
考点:考查电化学的相关知识。


科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:选择题
难溶化合物的溶解能力可以用溶度积Ksp来表示,当溶液中相应离子浓度的乘积大于该值时,会形成沉淀。已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若在常温下,向5 mL含有KCl和KI各为0.01 mol/L的溶液中加入8 mL 0.01 mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO3- )>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3- )>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3- )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3- )>c(Ag+)=c(Cl-)+c(I-)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二下学期期中考试化学试卷(解析版) 题型:选择题
A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是( )
A.M(A)=M(B)+M(C) B.2M(D)= M(B)+M(C)
C.M(B)< M(D)<M(C) D.M(D)<M(B)<M(C)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:填空题
(14分)常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
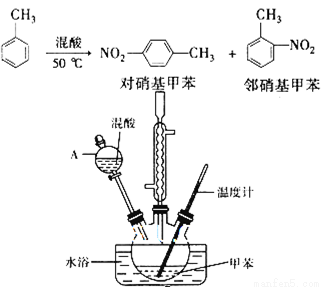
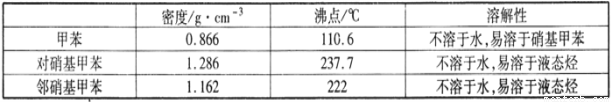
实验中可能用到的数据:
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是________。反应中需不断搅拌,目的是____________________
_____________________________。
(2)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
A.冷凝管 B.酒精灯 C.温度计 D.分液漏斗 e.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:选择题
化学与人类生活密切相关,下列与化学有关的说法不正确的是
A.开发和推广新能源是实现低碳生活的途径之一
B.化学药品着火,要立即用水或泡沫灭火器灭火
C.食品添加剂虽能改善食物味道等,但需限量使用
D.化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
关于下列各图的叙述,正确的是

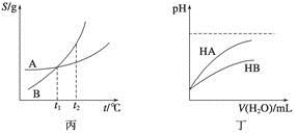
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ/mol
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1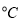 升温至t2
升温至t2 时,溶质的质量分数B>A
时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高二下学期升级考试化学试卷(解析版) 题型:选择题
分子式为C5H12的烃,其分子内含3个甲基,该烃的二氯代物的同分异构体的数目为
A.8种 B.9种 C.10种 D.11种
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,体积、物质的量浓度均相等的四种溶液:
①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
A.将①与②分别稀释相同倍数后溶液的pH:①>②
B.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3?H2O)
C.③与④中已电离的水分子的数目相等
D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三年级第三次考试理综化学试卷(解析版) 题型:简答题
(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。
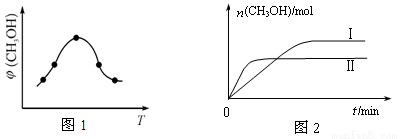
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比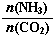 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com