
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.C元素的最高正价为+7价
B.原子半径:A>B>C
C.离子半径:A2->C->B2+
D.还原性:A2-<C-
科目:高中化学 来源:2016届山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:选择题
利用右图所示的装置进行下列实验,预测的现象和实际相符的是
选项 | ①中的物质 | ②中的物质 | ③中的物质 | 预测③中的现象 |
|
A | 浓氨水 | NaOH | AlCl3溶液 | 先产生白色沉淀,后沉淀溶解 | |
B | 浓盐酸 | MnO2 | KI溶液 | 溶液变蓝色 | |
C | 浓硫酸 | Na2SO4 | Ba(NO3)2溶液 | 无沉淀生成 | |
D | 浓硝酸 | Cu | 含酚酞的NaOH溶液 | 溶液红色褪去 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.Na2CO3固体中含有的少量NaHCO3,可用加热法除去
D.钠在不同条件下与氧气的反应,产物只得到Na2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
电瓶车所用电池一般为铅蓄电池(如图),是一种的可充电电池,电池总反应式为:
Pb+PbO2+2H2 SO4 2Pb SO4+2H2O。则下列说法正确的是
2Pb SO4+2H2O。则下列说法正确的是
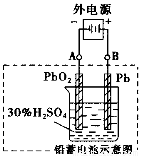
A.放电时,负极板上发生了还原反应
B.放电时,正极反应是:Pb-2e一+ SO42—=PbSO4
C.充电时,铅蓄电池的负极应与充电器电源的正极相连
D.充电时,阳极反应是:PbSO4-2e一+2H2O= PbO2+ SO42—+4H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强
B.饱和碳酸钠溶液中:c(Na+)=2c(CO32-)
C.饱和食盐水中:c(Na+) + c(OH-)c(Cl-)+ c(H+)
D.pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO32- 、SiO32-、AlO2- 、Cl- |
阳离子 | Al3+、Fe3+、Mg2+、NH4+ 、Na+ |
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示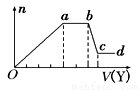 下列说法正确的是
下列说法正确的是
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2
查看答案和解析>>
科目:高中化学 来源:2016届宁夏固原一中高三上适应性训练理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗的值,下列有关说法正确的是
A.标准状况下,22.4LCH4和CH3CH2OH的混合物所含分子数为NA
B.常温常压下,16g14CH4所含中子数数目为8NA
C.15.6gNa2O2和水完全反应转移的电子数为0.2NA
D.0.1L3mol/L的NH4NO3溶液中含有的NH4+数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省宜春市高一上学期第三次月考化学试卷(解析版) 题型:填空题
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式);
(2)写出并配平该反应的化学方程式: ;
(3)发生还原反应的物质是 ,反应中2mol的氧化剂能___________(填“失去”或“得到”) mol电子。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上期末考试化学试卷(解析版) 题型:实验题
Ⅰ、亚硝酸钠在漂白、电镀等方面应用广泛。现在木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。

已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称__________________;
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________;
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式_________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________________ ;
(4)D装置中发生反应的离子方程式为__________________。
Ⅱ、焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:

实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为___________________;
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_______________;
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为____________(填序号);

实验二 葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
在上述实验过程中,若有部分HI被空气氧化,则测定结果__________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com