
科目:高中化学 来源:不详 题型:实验题
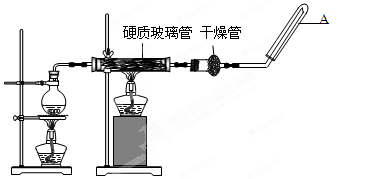
 ;
; 并指明该氧化还原反应的还原剂是 ,氧化剂是 。
并指明该氧化还原反应的还原剂是 ,氧化剂是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
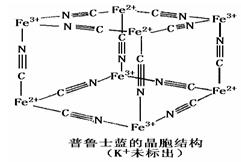
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.0075mol | B.0.0225mol |
| C.0.03mol | D.0.0175mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗 |
| B.反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2 |
| C.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当 |
| D.在反应②环丙胺的作用可能是促进氯化铁水解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4.18g | B.3.12g | C.4.68g | D.5.08 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 化合物的性质。过程如下:
化合物的性质。过程如下: H)3具有两性,Cu(OH)2也具有两性吗?
H)3具有两性,Cu(OH)2也具有两性吗?
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
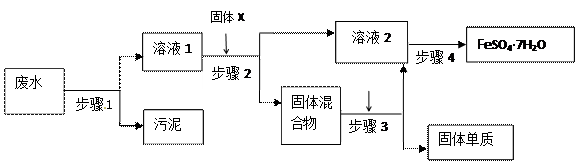 (1)步骤
(1)步骤 1的主要操作是 ,需用到的玻璃仪器有 , _______、 。
1的主要操作是 ,需用到的玻璃仪器有 , _______、 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ______________________。
______________________。 料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com