
已知酸性:![]() 现要将
现要将![]() 转变为
转变为![]() ,可行的方法是
,可行的方法是
[ ]
A.与足量NaOH溶液共热,再通入![]()
B.与稀硫酸共热后,再加入足量NaOH溶液
C.加热该物质溶液,再通入足量的![]()
D.与稀硫酸共热后,加入足量的![]()
科目:高中化学 来源:2012-2013学年浙江省(六校)高三第一次联考理综化学试卷(解析版) 题型:填空题
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市闸北区高三下学期二模化学试卷(解析版) 题型:选择题
已知酸性: ;现要将
;现要将 转变为
转变为
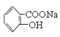 ,可行的方法是
,可行的方法是
A.与足量NaOH溶液共热,再通入足量CO2气体
B.与稀硫酸共热后,再加入足量NaOH溶液
C.该物质的溶液中加入足量的稀硫酸加热
D.与稀硫酸共热后,再加入足量的NaHCO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com