
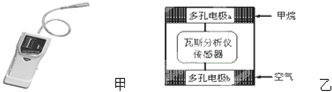
| A. | 电极b是正极,O2-由电极a流向电极b | |
| B. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| C. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol | |
| D. | 电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
分析 该装置是燃料电池,通入甲烷的电极a是负极、通入空气的电极b是正极,放电时,负极反应式为CH4+5O2--8e-═CO32-+2H2O,正极反应式为O2+4e-=2O2-,电子从负极沿导线流向正极,原电池内部阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:A.该原电池中,正极上氧气得电子发生还原反应,所以通入空气的电极b是正极,内电路中阴离子向负极移动,所以O2-由电极b流向电极a,故A错误;
B.电子不进入原电池内部,内电路是通过阴阳离子定向移动形成电流,故B错误;
C.每个O原子得到2个电子生成O2-,所以当固体电解质中有1mol O2-通过时,电子转移2mol,故C错误;
D.a是负极,负极上甲烷失电子和氧离子反应生成碳酸根离子和水,电极反应式为CH4+5O2--8e-═CO32-+2H2O,故D正确;
故选D.
点评 本题考查了化学电源新型电池的原电池原理应用,主要理解电池电解质不是在水溶液中的氧化还原反应,电解质是固体,O2-可以在其中自由移动,是本题的关键.


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
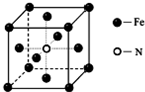 NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
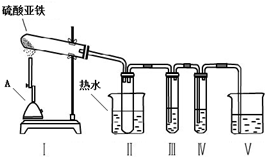
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 KSCN溶液(或B). | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加 2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 | 固体中含有FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
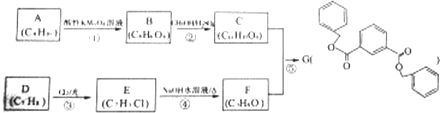
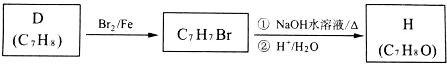
 .
.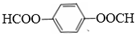 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com