
常温下向10 mL 0.1mol·L–1氨水中缓缓加蒸馏水稀释到1 L后,下列变化中正确的是
①电离程度增大;②c(H+)增大;③导电性增强;④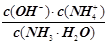 不变;⑤OH–数目增大,H+数目减小;⑥pH增大;⑦ c(H+)与c(OH–)的乘积减小
不变;⑤OH–数目增大,H+数目减小;⑥pH增大;⑦ c(H+)与c(OH–)的乘积减小
A.①②④ B.①⑤⑥ C.除②外都正确 D.①④⑤⑥⑦
A
【解析】
试题分析:①因加水促进弱电解质的电离,则氨水的电离程度增大,故①正确;②加水时氨水碱性减弱,即c(OH–)减小,但水的离子积Kw=c(H+)·c(OH–)不变,所以c(H+)增大,故②正确;③加水稀释时,溶液中离子总浓度减小,则导电性减弱,故③错误;④加水稀释时溶液温度不变,所以电离平衡常数也不变,即 不变,故④正确;⑤水可电离出H+和OH–,水的量增加,所以H+和OH–的数目都增大,故⑤错误;⑥c(H+)增大,则pH减小,故⑥错误;⑦温度不变,则水的离子积不变,即c(H+)与c(OH–)的乘积不变,故⑦错误。正确答案选A。
不变,故④正确;⑤水可电离出H+和OH–,水的量增加,所以H+和OH–的数目都增大,故⑤错误;⑥c(H+)增大,则pH减小,故⑥错误;⑦温度不变,则水的离子积不变,即c(H+)与c(OH–)的乘积不变,故⑦错误。正确答案选A。
考点:考查溶液稀释对弱电解质电离平衡的的影响。


科目:高中化学 来源:河南省许昌高中2010-2011学年高二12月月考化学试题 题型:013
|
草酸是二元中强酸,草酸氢钠溶液显酸性.常温下向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是 | |
| [ ] | |
A. |
V (NaOH)=0时,c(H+)=1×10-2 mol·L-1 |
B. |
V (NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
C. |
V (NaOH)=10 mL时,c(H+)=1×10-7 mol/L |
D. |
V (NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省西华一高高三上学期第一次月考化学试卷(带解析) 题型:填空题
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0  的
的 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈? ?(填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期第一学段考试化学试卷 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸是二元中弱酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com