
1molCH4和Cl2发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的Cl2为( )
A.0.5 mol B.2 mol
C.2.5 mol D.4 mol
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。
(1)右图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1, 请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式 。
 (2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
①请写出甲烷燃料电池中a极的电极反应式为 。
②此时电池内的总反应方程式为 。
 (3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
(3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
①CH4与Cl2发生反应的条件是 ;若用日光直射,可能会引起 。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出, , 等。
③用饱和食盐水而不用谁的原因是 。
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2 → 2COCl2+2HCl,上述反应 (填选项符号,下同)
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸
D.水 E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
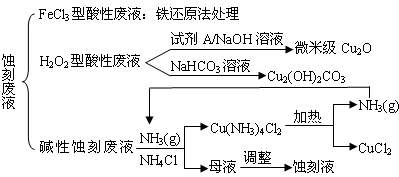
(18分)近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 ▲ 、 ▲ 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
▲ 。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 ▲ (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 ▲ 。
⑸ 碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2= 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com