
【题目】下列有关物质分类正确的是( )
A.硫酸、盐酸均为电解质B.Na2O2为碱性氧化物
C.NaOH、NH3H2O都为可溶性碱D.蛋白质溶液、液氯均属于分散系
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
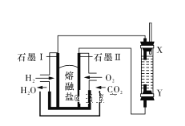
A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中的电解液为蒸馏水
D. 若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液化石油气的主要成分为丙烷,在燃烧时能放出大量的热,作为能源应用于人们的日常生产和生活。
已知:①C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l)△H1=-2219.9kJ/mol
3CO2(g)+4H2O(l)△H1=-2219.9kJ/mol
②2COg)+O2(g)═2CO2(g)△H2=-566kJ/mol
(l)反应2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)的△H=______.
(2)C3H8在不足量的氧气里燃烧,生成CO和气态水,以它们为原料制备甲醇的工业流程如下:
![]()
反应室1为一个容积为10 L的密闭容器,在850℃发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),CO(g)和H2O(g)浓度随反应时间的变化如下图所示:

0~4 min的平均反应速率v(CO2)= ___,该反应在850℃时的化学平衡常数K= ___.
(3)恒压下,0.2 mol CO2与0.6 mol H2在催化剂作用下在反应室2(容器的容积可变)中发生反应生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H ,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H ,CO2的平衡转化率与温度、压强的关系如图所示。

①该反应的△H __ 0(填“<”或“>”)。
②压强P1 __ p2(填“<”或“>”)。
③在P1、100℃条件下,反应达到平衡后再向容器中加入0.1 mol CO2和0.3 mol H2,反应重新达到平衡时,CO2的平衡转化率____50%(填“<”“>”或“=”),CH3OH 的平衡体积分数____(填“增大”“不变”或“减小”)。
④将a点的平衡混合物通入1 L 0.15 mol/LNaOH溶液中,充分吸收后,所得溶液中的溶质除甲醇外,还有____,所得溶液中各离子的物质的量浓度由大到小的顺序为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础] 有机物H广泛用于香精的调香剂。为了合成有机物H,某实验室的科技人员设计了下列合成路线:

已知以下信息:
①E分子中含两个甲基,不含环状结构;
②G为芳香族化合物,不能与FeCl3溶液发生显色反应;

回答下列问题:
(1)A的名称(系统命名)是 ___,B的结构简式为____。
(2)C中官能团名称是____D—E的反应类型是____。
(3)F的结构简式为____,F—G的反应类型是____。
(4)E与G反应生成H的化学方程式为____。
(5)满足以下条件的D的同分异构体有____种,其中核磁共振氢谱只有4组峰的是____(写结构简式)。i)属于酯且能发生银镜反应 ii)能与钠反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为___________。

(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_____(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中的杂质,欲用括号内物质除去,其中能达到目的的是( )
A.CO2中有少量CO(灼热的铜网)B.MgO中有杂质Al2O3(浓氨水)
C.NaCl溶液中有杂质Na2SO4(硝酸钡)D.FeSO4溶液中有杂质CuSO4(铁粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH-4 e-=== O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为![]() ,在不同温度下其离子积常数为
,在不同温度下其离子积常数为![]() ,
,![]() 。则下列关于纯水的叙述正确的是
。则下列关于纯水的叙述正确的是
A. ![]() 随着温度升高而降低
随着温度升高而降低
B. 在35℃时,![]()
C. 25℃时水的电离程度大于35℃时水的电离程度
D. 水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】良好生态环境是最普惠的民生福祉。治理大气污染物CO、NOX、SO2具有十分重要的意义。
(1)氧化还原法消除NOX的转化如下所示: 。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。
。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。
(2)吸收SO2和NO获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。

装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式_______________。装置III中发生反应的离子方程式为_________________。
(3)已知进入装置IV的溶液中NO2-的浓度为a mol·L-1,要使1L该溶液中NO2-完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气____L(用含a代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com