6.4gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2) 若干,这些混合气体恰好能被500mL 1mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3和NaNO2的物质的量之比为( )
(已知:NO+NO2+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO3+NaNO2+H2O )
A.2:1
B.1:1
C.4:1
D.1:3
【答案】
分析:纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO
3)
2,另一个是HNO
3到NaNO
2,根据电子转移守恒可知,铜失去的电子等于HNO
3到NaNO
2得到的电子,故2n(Cu)=2n(NaNO
2),据此计算溶液中n(NaNO
2).气体与氢氧化钠反应的盐溶液为NaNO
3、NaNO
2混合溶液,根据钠离子守恒有n(NaNO
3)+n(NaNO
2)=n(Na
+),据此计算溶液中n(NaNO
3),据此解答.
解答:解:纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO
3)
2,每个Cu升2价,失2个电子;另一个是HNO
3到NaNO
2,每个N降2价,得2个电子.根据电子转移守恒可知,铜失去的电子等于HNO
3到NaNO
2得到的电子,故2n(Cu)=2n(NaNO
2),故n(NaNO
2)=n(Cu)=
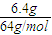
=0.1mol,
气体与氢氧化钠反应的盐溶液为NaNO
3、NaNO
2混合溶液,根据钠离子守恒有n(NaNO
3)+n(NaNO
2)=n(Na
+),
所以溶液中n(NaNO
3)=n(Na
+)-n(NaNO
2)=0.5L×1mol/L-0.1mol=0.4mol,
溶液液中NaNO
3和NaNO
2的物质的量之比为0.4mol:0.1mol=4:1,
故选C.
点评:本题考查混合计算、氧化还原反应计算等,难度较大,判断铜失去的电子等于HNO
3到NaNO
2得到的电子是解题关键,注意氧化还原反应中守恒思想的运用.

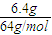 =0.1mol,
=0.1mol,

 阅读快车系列答案
阅读快车系列答案