
【题目】乙醇做为可再生能源比化石能源具有较大的优势,如图为乙醇燃料电池,该电池的总反应方程式为C2H5OH+3O2=2CO2+3H2O。下列关于该电池叙述错误的是

A.a极与用电器的正极相接B.该装置将化学能转化为电能
C.质子(H+)由装置左侧向右侧移动D.该装置的电解质溶液呈酸性
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A. 接近称量质量时,轻振手腕,加够药品
B. 溶解时,用量筒控制所加蒸馏水的量
C. 移液时,玻璃棒插在刻度线上,防止液体洒出![]()
D. 接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池领域作出巨大贡献的三位科学家。某锂离子电池以![]() 为负极,
为负极,![]() 为正极,锂盐有机溶液作电解质溶液,电池反应为
为正极,锂盐有机溶液作电解质溶液,电池反应为![]() 。则下列有关说法正确的是( )
。则下列有关说法正确的是( )
A.金属锂的密度、熔点和硬度均比同族的碱金属低
B.该锂离子电池可用乙醇作有机溶剂
C.电池放电时,![]() 从正极流向负极
从正极流向负极
D.电池充电时,阳极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为原料合成有机化合物M和N的路线如下:
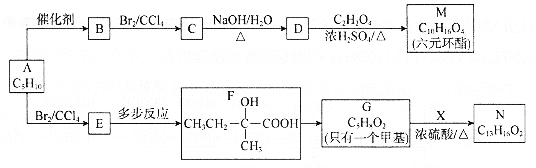
已知:a.在催化剂作用下,烯烃分子间的双键碳原子可以互换而发生烯烃复分解反应: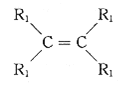 +
+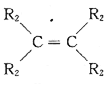
![]() 2
2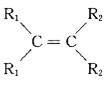
b.X的苯环上有2种等效氢,且只含1个甲基。
回答下列问题:
(1)根据系统命名法,B的名称是________。N中含氧官能团的名称为________。
(2)M的结构简式是________。
(3)F→G的反应类型是________。
(4)写出C→D的化学方程式________。
(5)同时满足下列两个条件的N的同分异构体共有________种;
①能够发生银镜反应且该物质与生成Ag的物质的量之比为1:4;
②苯环上连接—C5H11。
上述同分异构体中,核磁共振氢谱有5组峰且峰面积之比为9:2:2:2:1的有________和________(写结构简式)
(6)写出以CH2=CH(CH2)4CH=CH2为原料制备![]() 的合成路线________(其他试剂任选)
的合成路线________(其他试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、________、________可制得精盐。(填具体操作名称)
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
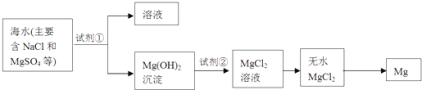
①为了使MgSO4转化为Mg(OH)2 , 试剂①可以选用________。
②试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是________。
A.Mg(OH)![]() MgO
MgO![]() Mg B.Mg(OH)
Mg B.Mg(OH)![]() MgO
MgO![]() Mg
Mg
C.Mg(OH)2![]() MgCl2
MgCl2![]() Mg D.Mg(OH)2
Mg D.Mg(OH)2![]() MgCl2
MgCl2![]() Mg
Mg
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
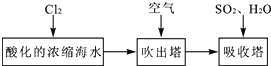
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
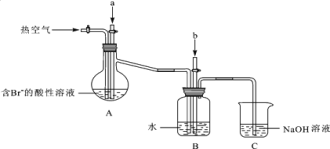
①A装置中通入a气体的目的是(用离子方程式表示)______________________________;
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是___________;
③反应过程中,B装置中有SO42﹣生成,检验SO42﹣的方法是____________________________;
④C装置的作用是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com