
下列溶液中 ,与100 ml
,与100 ml  0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A、1 00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
C、50  ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
2现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池
(A) ; (B) ;(填“能”与“不能”)
(2)根据能设计成原电池的反应选择适宜的材料和试剂设计一个原电池:
①负极材料是 ; 电解质溶液是 .(填化学式)
②写出电极反应式:负极 ;正极 .
③若导线上转移电子1mol,则负极质量变化 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应达到平衡后增大压强或降低温度,平衡都向正反应方向移动的是( )
|
| A. | 2NO2(g)⇌N2O4(g);△H<0 | B. | 3O2(g)⇌2O3(g);△H>0 |
|
| C. | H2(g)+I2(g)⇌2HI(g);△H<0 | D. | 2NH3(g)⇌3H2(g)+N2(g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L物质的量浓度为2mol/l的K2SO4溶液中K+的物质的量浓度为 ( )
A.2mol/l B.4mol/l C.1 mol/l D.20mol/l
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是 ( )
①将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
② 将14.2 g Na2SO4 溶于100ml水中制成溶液
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①② B.①②③
C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室配制500ml0.2m ol/L的Na2SO4溶液,实验操作有以下步骤:
ol/L的Na2SO4溶液,实验操作有以下步骤:
a.在托盘天平上称量出14g Na2SO4放于烧杯中加适量蒸馏水溶解并冷却至室温;
b.把制得的溶液小心转移至容量瓶中;
c.继续用烧杯向容量瓶中加水至凹液面与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2-3次 ,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
e.将容量瓶瓶塞塞紧,充分摇匀;
f.将所得溶液倒入指定试剂瓶中,贴好标签封存备用。
填写下列空白:
(1)操作步骤的正确顺序是 (填序号)。
(2)本实验用到的基本仪器已有托盘天平(带砝码)、镊子,
还缺少的仪器有 。
(3)上述步骤中有明显错误的是 (填序号)。
(4)下列情况会使所配制溶液浓度偏高的是 (填序号):
①定容时俯视;②定容时仰视;③没有进行上述操作步骤d;④加水时不慎超过了刻度线,发现后用胶头滴管吸出;⑤称量时用的砝码上沾有杂质;⑥容量瓶使用前没有干燥内壁附有水珠。
查看答案和解析>>
科目:高中化学 来源: 题型:
从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列平衡,故可用作酸、碱指示剂:
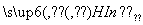 H+(溶液)+
H+(溶液)+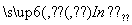
在上述溶液中加入下列物质,最终能使指示剂显黄色的是( )
A.盐酸 B.NaHCO3溶液
C.NaHSO4溶液 D.Na2O2(固体)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 |
|
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 |
|
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子数 |
|
| D. | 催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是( )
A. 砷在通常状况下为固体
B. 砷的最高正化合价为+5
C. 砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强
D. 砷化氢(AsH3)不如氨气(NH3)稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com