【答案】
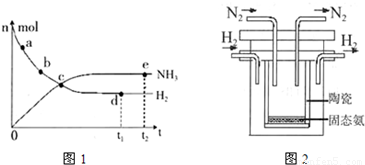
分析:(1)A.浓度越大反应速率越快;
B.a、b、c之后氢气的物质的量继续变化,未达到平衡,反应向正反进行;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动;
(2)令转化的氮气的物质的量为ymol,利用三段式表示出平衡时各组分的物质的量,根据氨气的体积分数列方程计算y的值,计算平衡浓度,倒入平衡常数表达式计算;
(3)K值越大,表示反应进行程度大,但该温度下不一定反应发生,氢气的转化率与氮气、氢气的投入量等有关,转化率不一定高,氨气的产率与与氮气、氢气的投入量等有关,产量不一定大;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气.
解答:解:(1)A.a点反应物的浓度大于b点,浓度越大反应速率越快,故a点反应速率更大,故A正确;
B.点c之后氢气的物质的量继续减小,未达到平衡,反应向正反进行,故B错误;
C.d、e对应氢气、氨气的物质的量不变,处于平衡状态,点d和点e处的n (N
2)相同,故C正确;
D.该反应正反应是放热反应,温度升高平衡向逆反应移动,氨气的物质的量减小,故D错误;
故选AC;
(2)令平衡时转化的氮气的物质的量为ymol,则:
N
2(g)+3H
2(g)?2NH
3(g)
开始(mol):0.8 1.6 0
变化(mol):x 3x 2x
平衡(mol):0.8-x 1.6-3x 2x
故
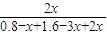
=20%,解得x=0.2,
故 N
2、H
2、NH
3的平衡浓度分别为
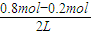
=0.3mol/L、
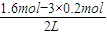
=0.5mol/L、
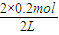
=0.2mol/L
故该温度下平衡常数k=
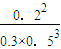
=1.07,
故答案为:1.07;
(3)A.氢气的转化率与氮气、氢气的投入量等有关,K值大,氢气转化率不一定高,故A错误;
B.氨气的产率与与氮气、氢气的投入量等有关,K值大,氨气的产量不一定大,故B错误;
C.K值越大,表示反应进行程度大,即正反应进行得越完全,故C正确;
D.K值越大,表示反应进行程度大,但该温度下不一定反应发生,反应速率不一定大,故D错误;
故选C;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N
2+6H
++6e
-=2NH
3,
故答案为:N
2+6H
++6e
-=2NH
3.
点评:本题考查化学平衡图象、化学平衡常数计算与意义、电解原理等,难度不大,注意理解平衡常数的意义.

 =20%,解得x=0.2,
=20%,解得x=0.2,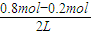 =0.3mol/L、
=0.3mol/L、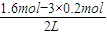 =0.5mol/L、
=0.5mol/L、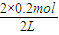 =0.2mol/L
=0.2mol/L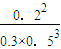 =1.07,
=1.07,

 步步高达标卷系列答案
步步高达标卷系列答案

 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。