
| A.只有①② | B.只有①③④ | C.只有①②③ | D.全部 |
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:不详 题型:单选题
| A.C1 =2C2 | B.C1 >2C2 | C.C1 <2C2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
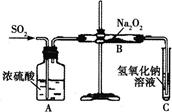
 设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
设计一种实验方案证明Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否由Na2SO4生成,他们设计了如下方案:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫化氢分子很稳定,受热难分解 |
| B.硫化氢分子中所有原子的最外层电子都达到8电子结构 |
| C.将硫化氢通入溴水,溴水褪色 |
| D.硫化氢是电解质,其电离方程式是 H2S = H+ + HS- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 |
| B.将氢氧化铁胶体与氯化铁溶液分别加热蒸干并灼烧,最终得到的物质成分不同 |
C.向NaClO溶液中通入足量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO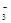 |
| D.铁粉与足量稀硝酸反应时,氧化剂与还原剂的物质的量之比为2∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①③④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
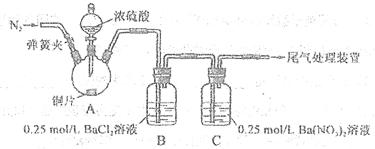
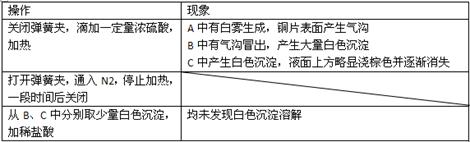
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,并在方程式上标出电子转移的方向与数目。
,并在方程式上标出电子转移的方向与数目。| A.MnO2 | B.H2S | C.稀H2SO4 | D.NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com