
【题目】【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO42-、AlO2- B. H+、Fe2+、NO3-、Cl-
C. Mg2+、Na+、Cl-、SO42- D. Na+、K+、OH-、HCO3-
科目:高中化学 来源: 题型:
【题目】下列关于等电子体的说法中,正确的是
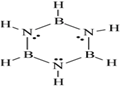
A. N2与CO不属于等电子体,故它们的熔沸点、溶解度相差较大
B. PO43-与SO42-不属于等电子体,故结构不相似
C. NO2-与O3属于等电子体,故NO2-为O2的同素异形体
D. 苯与硼氮苯(路易斯结构式如上图)属于等电子体,故硼氮苯中含有大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应①Fe(s)+C02(g) ![]() FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g) ![]() 2C02(g) △H2=b kJ·mol-
2C02(g) △H2=b kJ·mol-
反应③2Fe(s)+02(g) ![]() 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a ___________0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有NH4+、Na+、Mg2+、NO3-4种离子,若向其中加入少量过氧化钠固体后溶液中离子浓度基本保持不变的是( )
A. Mg2+B. Na+C. NH4+D. NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①HCl溶液 ②H2O ③C2H5OH 都能与Na反应放出H2,其产生H2的速率排列顺序正确的是
A.①>②>③ B.②>①>③ C.③>①>② D.②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)工业上可在碱性溶液中通过电解的方法实现由N2制取NH3:
2N2+6H2O![]() 4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
4NH3+3O2通入N2的一极是______(填“阴极”或“阳极”)阳极的电极反应式是_________________。
(2)有人设想寻求合适的催化剂和电极材料.以N2,H2为电极反应物;以HCl-NH4Cl为电解质榕液制取新型燃料电池。请写出该电池的正极反应式________________。
(3)电解原理在化学工业中有着广泛的应用。若用惰性电极电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生的气体672mL(标准状况下)时,溶液的c(H+)=_____(假设电解后溶液体积不变)。
(4)铁、铝是现代金属材料的主角。
已知铝的燃烧热为1675kJ/mol,2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-822kJ/mol;
则2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △H=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为C5H10O,它能发生银镜反应,若将它与H2加成,所得产物的结构简式可能是
A.( CH3)3CCH2OH B.CH3CH2CH(OH)CH2CH3
C.CH3CH(OH)CH2CH2CH3 D.CH3CH2C(CH3)2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com