
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.同体产物为MgO。
II.假设为______________。
III.假设为:______________。
请回答下列问题:
资料信息:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
(1)如图连接好仪器,装药品前如何检验装置的气密性_______。

(2)装置B中盛装的干燥剂可以是(填序号)_______。
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的都是______________。
(4)E中收集到的气体对氢气的相对密度是14,该气体是_______。
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设_______成立。C中发生的化学反应方程式为______________
(6)本实验中存在明显缺陷,改进措施是___________
Ⅱ.固体产物为Mg3N2
III.固体产物为MgO和Mg3N2
(1)关闭分液漏斗活塞和活塞K,将导气管末端插入水中,对锥形瓶(或C处反应管)微热,若导气管口有气泡,停止加热,导气管中进入一段水柱,表示气密性良好。
(2)②④
(3)排净装置中空气,防止空气干挠实验。
(4)N2
(5)假设III 4Mg+2NO2 4MgO+N2 3Mg+N2
4MgO+N2 3Mg+N2 Mg3N2
Mg3N2
(6)活塞K处的导气管插入NaOH溶液中,进行尾气吸收。
【解析】
试题解析:Mg与NO2反应,根据原子守恒,则产物可能是MgO、Mg3N2或MgO和Mg3N2
(1)检验装置气密性通常用加热法,即将各个活塞关闭,将导管末端伸入水中,微热气体发生装置,看是否产生气泡,停止加热后,看导管中是否有一段水柱。
(2)NO2可与浓硫酸、NaOH反应,因此不能用浓硫酸、碱石灰干燥。
(3)为防止Mg与空气中的N2、O2反应对实验产生干扰,需排尽装置中空气。
(4)收集的气体对氢气的相对密度是14,则气体的相对分子质量是2×14=28,气体为N2。
(5)若产物只有MgO,则固体质量是反应前的 ≈1.7倍,若产物只有Mg3N2,则固体的质量是反应前的
≈1.7倍,若产物只有Mg3N2,则固体的质量是反应前的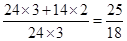 ≈1.4倍,实验得到的固体质量是反应前的1.5倍,则得到的是MgO和Mg3N2的混合物,故假设III成立。
≈1.4倍,实验得到的固体质量是反应前的1.5倍,则得到的是MgO和Mg3N2的混合物,故假设III成立。
仿照Mg与CO2的反应,可知Mg与NO2反应生成MgO和N2,产生N2继续和Mg反应得到Mg3N2。
(6)比较明显的缺陷是,排尽装置空气时,产生的NO2在活塞k处直接排入空气中,会污染环境,因此需将活塞k处的导管通入NaOH溶液中。
考点:考查化学实验原理分析,气密性检查,试剂选择,实验装置的作用,实验数据处理,实验装置改进等。


科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:058
某课外活动小组试用电解法根据电极上析出物质的质量来测定铜的相对原子质量,其实验原理为:电解硫酸铜溶液时Cu2+在电极上放电析出,根据析出Cu的质量计算其相对原子质量.已知在测定过程中溶液中c(Cu2+)以保持不变为宜.试回答:
(1)选择电极材料,画出装置示意图.
(2)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是:________(选填下列操作步骤的编号)
①称量电解前电极质量,②刮下电解后电极上的铜并清洗,
③用蒸馏水清洗电解后的电极,④低温烘干电极后称量,
⑤低温烘干刮下的铜后称量,⑥再次低温烘干后称量至恒重.
(3)若电流强度为I A,通电时间为t s后,精确测得电极上析出的铜的质量为m g.已知电子的电量为e C,阿伏加德罗常数为NA.试列出铜的相对原子质量的计算表达式:Mr(Cu)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三第一学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
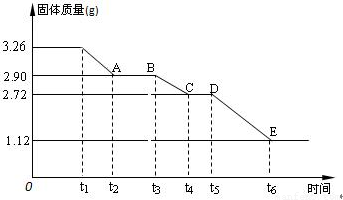
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省三明市高三上学期联合命题考试化学试卷 题型:填空题
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
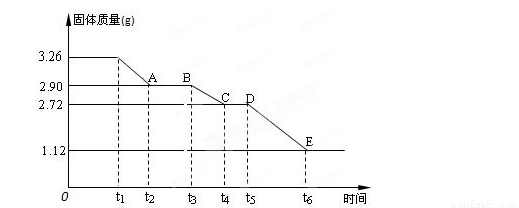
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲同学的方案是:将样品溶解,加过量氯化钡溶液,过滤洗涤,取沉淀烘干,称量得固体n g。则混合物中碳酸钠的质量分数为_____________;若Ca2+、Ba2+都可使![]() 沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是__________________________________。
沉淀完全,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因是__________________________________。
(2)乙同学的方案如图所示:
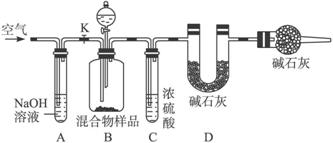
根据该实验方案,乙同学在实验中必须准确测定的数据是_____________;当混合物样品充分反应完全时,缓慢通入空气的目的是_____________,其中,装置A的作用是_____________。
装置E的作用是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com