
 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象.图中所示的实验,点滴板上描述的实验现象正确的是( )| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①② |
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| B. | 铝热剂焊接钢轨主要利用的是光能 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成56.0LN2(标准状况) | |
| B. | 有0.300molKNO3被氧化 | |
| C. | 被氧化的N原子的物质的量为4.75mol | |
| D. | 转移电子的物质的量为1.50mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
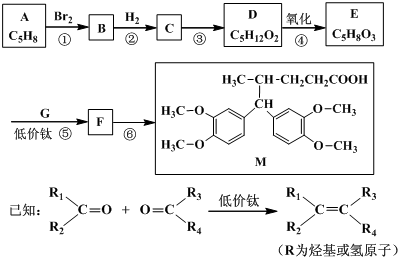
 (其中之一);.
(其中之一);. 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com