
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气。
(1)该反应的化学方程式是:__________,改写成离子方程式是__________。
(2)电解食盐水的过程中,被氧化的元素是__________,被还原的元素是__________。
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入4molA和2molB发生反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB
B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB
D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力车在刹车和下坡时处于充电状态;上坡或加速时,电动机提供辅助推动力,降低了汽油的消耗。该车一般使用的是镍氢电池采用镍的化合物和储氢金属(以M表示)为两电极材料,碱液(主要为KOH)电解液。镍氢电池充放电原理如图,其总反应式为:H2+2NiOOH = 2Ni(OH)2 下列有关判断正确的是( )

A. 在上坡或加速时,溶液中的K+向甲电极迁移
B. 在刹车和下坡时,甲电极的电极反应式为:2 H2O+2e- H2↑+2OH-
C. 在上坡或加速时,乙电极周围溶液的pH将减小
D. 在刹车和下坡时,乙电极增重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14 g Na2O和Na2O2的混合物加入足量的水中充分反应后,生成标准状况下的气体1.12 L,所得溶液的体积为400 mL。试计算:
(1)原混合物中Na2O的质量为________ g。
(2)所得溶液的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸铜钡是当今用最新科学技术才能合成的一种物质.然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡.下列关于硅酸铜钡的学说错误的是( )
A.易溶于水
B.难溶于水
C.属于硅酸盐
D.有颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油和煤可以得到有机化工生产中需要的众多原料,如由石油裂解得到的乙烯和由煤干馏得到的苯制聚苯乙烯。生产过程如下:
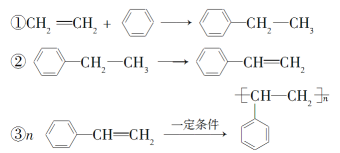
下列说法不正确的是( )
A. 通过裂解可以从石油中获得很多重要的化工原料
B. 将煤干馏不能直接得到纯净的苯
C. 制聚苯乙烯的反应①为加成反应,反应②为消去反应
D. 反应①②③的原子利用率都达到了100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存与发展必不可缺的物质,对传统能源进行脱硫、脱硝处理,能提高能源在能源消费中的比例是改变目前我国频发的雾霾天气的有效措施。
(1)肼(N2H4)和化合物甲是一种重要的火箭推进剂,甲分子与肼分子具有相同的电子数,二者反应的生成物中有10e-分子,另一种生成物为极稳定的单质,写出该反应的化学方程式__________________。
(2)对燃煤产生的尾气进行回收处理,有助于空气质量的改善,还能变废为宝,尾气处理过程中涉及到的主要反应如下:
①2CO(g)+SO2(g)=S(g)+2CO2(g) △H=十8.0 kJ·mol-1
②2H2 (g)+SO2(g)=S(g)+2H2O(g) △H=+90.4 kJ·mol-1
③2CO(g)+O2 (g) =2CO2 (g) △H= -566.0 kJ·mol-1
④2H2 (g)+O2 (g) =2H2O(g) △H =-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为__________________。
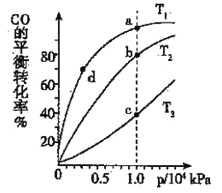
(3)煤炭液化也有助于减少雾霾天气的发生,液化反应之一为:CO(g)+2H2(g)![]() CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
CH3OH(g)(正反应放热);按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右图所示,则正反应速率:v(a)、v(b)、v(c)、v(d)由小到大的顺序为__________;实际生产条件控制在T 1°C、1×106Pa左右,选择此压强的理由是________。
(4)工业上生产新能源二甲醚(CH3OCH3)的原理之一为:2CO(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
CH3OCH3(g)+3H2O(g),相同温度下,在两个容器中进行上述反应,某时刻两容器中各气态物质的浓度(mol/L)及正逆反应速率之间的关系如下表所示:
容器 | c(CO) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)与v(逆)大小比较 |
I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)= v(逆) |
II | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v(正)____v(逆)(填“>” |
填写表中空白处,并写出其推测过程___________。
(5)二甲醚(燃烧热为1455kJ/mol)燃料电池是一种绿色电池,其工作原理如图所示,a、b均为惰性电极,a极的电极反应式为________________________;当消耗1molO2时,通过质子交换膜的质子数为_________NA;若电池工作时消耗1mol二甲醚所能产生的最大电能为1320kJ,则该燃料电池的工作效率为________(燃烧电池的工作效率是指电池所能产生的最大电能与燃料燃烧时所能释放的全部热能之比)。
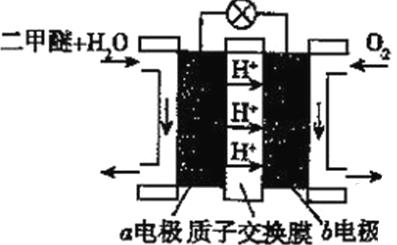
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com