
科目:高中化学 来源: 题型:
为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于O2流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗O2 6.72 L(标准状况下),则该物质中各元素的原子个数比是N(C):N(H):N(O)= 。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为 ,该物质的分子式是 。

(3)根据价键理论,预测A的可能结构并写出结构简式: 、 。
(二)结构式的确定:
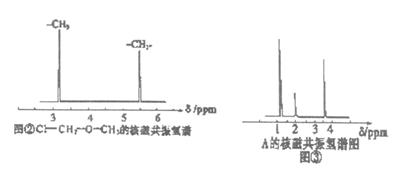
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②。经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为 。
(三)性质实验:
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学方程式: 。
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中错误的是( )
A. CCl4可以由CH4制得,它可用于萃取碘水中的碘
B.相等的物质的量的乙烯和甲烷完全燃烧后产生的水的质量相同
C. 用乙烯与HCl反应来制备氯乙烷比用乙烷与氯气反应更好
D. 甲烷不能使酸性高锰酸钾溶液褪色,因此甲烷不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是 ( )
A.硒化氢是无色、有毒、比硫化氢稳定的气体
B.砹化银不溶于水也不溶于稀硝酸
C.硫酸镭是难溶于水的白色固体
D.锗单质是一种优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在元素周期表中的位置如右下图所示。下列说法正确的是( )
 A.原子半径的大小为:Z>Y>X
A.原子半径的大小为:Z>Y>X
B.气态氢化物的还原性:Z<Y
C.若Y可作半导体材料,则X、Z的单质常温下均为气体
D.若Y与Z的核电荷数之和为X的4倍,则X、Z各自形成的氢化物熔沸点:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学”是当今社会提出的—个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学原子经济要求的是
A.乙烯聚合为聚乙烯高分子材料
B.甲烷与氯气制备—氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜
D.用二氧化硅制备高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
 (1)E2+ 的核外电子排布式为 。
(1)E2+ 的核外电子排布式为 。
(2)CB32—的立体构型是(用文字描述) ;
其中心原子的杂化轨道类型为 。
(3)根据等电子原理,AB分子的电子式为 ;
其中σ键与π键之比为 。
(4)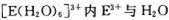 间的作用力为 。
间的作用力为 。
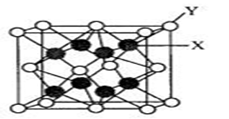
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com