
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(PH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
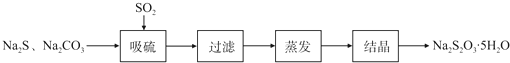
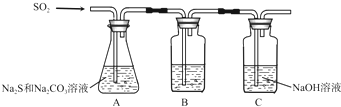
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, |
样品含NaCl | |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, |
样品含NaOH |
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:058
为了测定工业烧碱中NaOH的质量分数做了如下试验,试回答下列有关问题.
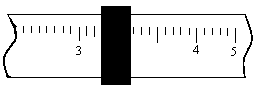
(1)样品称量:在质量为28.1g干净的烧杯中,放入工业烧碱的样品,用托盘天平进行称量,若右盘上放砝码30g,游码位置如下图,天平的指针在标尺中间.则样品质量为________.
(2)配制溶液:把称得的烧碱样品放入烧杯中,加适量蒸馏水溶解,用玻璃棒搅拌,完全溶解后,待________后,将溶液转入1000 mL容量瓶里,用蒸馏水洗涤烧杯和玻璃棒,并把洗涤液注入容量瓶,振荡容量瓶里的溶液使混合均匀,然后再缓缓加蒸馏水直至液面离刻度线________cm处,改用________加水到瓶颈刻度处,使溶液的凹面正好和刻度相平.把容量瓶塞好,反复摇匀后,倒入干燥洁净的试剂瓶里备用.
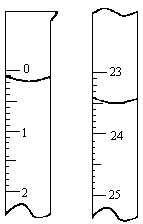
(3)滴定:用碱式滴定管准确量取20.00 mL待测的NaOH溶液注入锥形瓶,向锥形瓶里滴入3滴酚酞试液,然后用0.10 mol/L的盐酸标准溶液测定,盐酸在酸式滴定管的初读数和末读数如下图所示,盐酸的末读数为________ mL,初读数为________ mL,盐酸的用量为________ mL.
(4)计算:样品中NaOH的质量分数为________.
查看答案和解析>>
科目:高中化学 来源:江苏省无锡市2012届高三上学期期中考试化学试题 题型:058
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4·yCu(OH)2].为了加以验证,小组成员进行了如下实验:
①分别配制50 mL物质的量浓度均为0.100 mol·L-1 CuSO4溶液和NaOH溶液;
②准确量取10 mL CuSO4溶液倒入50 mL烧杯中;
③向烧杯中匀速加入0.100 mol·L-1 NaOH溶液,并每加入1.00 mL NaOH溶液用pH计测一次混合溶液的pH;
④当滴人NaOH溶液的体积达到30 mL时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时pH变化曲线.
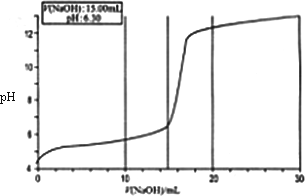
请回答以下问题:
(1)V(NaOH)在0.00 mL~2.00 mL之间时,溶液中无沉淀产生,但pH变化较快的原因是________;
(2)V(NaOH)在2.00 mL~15.00 mL之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜.已知蒸馏水的pH为6.32,当V(NaOH)为15.00 mL时,溶液pH为6.30,则可求得x=________,y=________;
(3)V(NaOH)在17.00 mL~20.00 mL之间时,溶液中出现蓝色沉淀,并不断增加.已知V(NaOH)为20.00 mL时,溶液pH为12.25,则此时沉淀中________(填“含”或“不含”)有碱式硫酸铜,理由是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com