
【题目】已知:
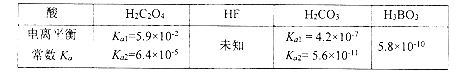
(1)为了证明HF是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
① 甲同学取一定体积的HF溶液,滴入2 滴紫色石蕊试液,显红色,再加入NaF 固体观察到的现象是__________________,则证明HF 为弱酸.
② 乙同学取10ml未知浓度的HF 溶液,测其pH 为a ,然后用蒸馏水稀释至1000mL .再测其pH 为b ,若要认定HF 为弱酸,则a 、b 应满足的关系是b <_____________(用含a 的代数式表示)。
③ 丙同学用pH 试纸测得室温下0.10mol.L-1的HF 溶液的pH为2 ,则认定HF为弱酸,由丙同学的实验数据可得室温下HF 的电离平衡常数约为_______________.
(2)① 己知H3BO3 与NaOH 溶液反应的离子方程式为H3BO3 +OH-=B(OH)4- ,写出硼酸的电离方程式_____________________.
② 向等浓度的H2C2O4 与H3BO3混合溶液中逐滴加入NaOH 溶液,则与OH- 作用的粒子(包括分子和离子)依次为_____________,______________,_____________。
(3)向NaHC2O4 溶液中加入少量的Na2CO3 溶液,反应的离子方程式_______________.
【答案】
(1)①.红色变浅;②a+2;③1.0×10-3;
(2)①.H3BO3+H2O ![]() B(OH)4-+H+;②.H2C2O4、 HC2O4- 、H3BO3;
B(OH)4-+H+;②.H2C2O4、 HC2O4- 、H3BO3;
(3)2HC2O4- 十CO32- =2C2O42-+H2O +CO2↑;
【解析】
试题分析:根据几种酸的电离常数的大小可知,酸性H2C2O4>HC2O4->H2CO3>H3BO3>HCO3-。
(1)①加入NaF 固体,增大了F-浓度,若看到红色变浅,说明溶液中存在HF![]() H++ F-的平衡,说明HF 为弱酸,故答案为:红色变浅;
H++ F-的平衡,说明HF 为弱酸,故答案为:红色变浅;
②若HF 为弱酸,将10ml未知浓度的HF 溶液,用蒸馏水稀释至1000mL,溶液的pH变化将小于2,即b <a+2,故答案为:a+2;
③室温下0.10mol.L-1的HF 溶液的pH为2,则c(H+)=c(F-)=0.01mol/L,HF 的电离平衡常数=![]() ≈1.0×10-3,故答案为:1.0×10-3;
≈1.0×10-3,故答案为:1.0×10-3;
(2)① 根据H3BO3 与NaOH 溶液反应的离子方程式为H3BO3 +OH-=B(OH)4- ,说明H3BO3为一元酸,硼酸的电离方程式为H3BO3+H2O ![]() B(OH)4-+H+,故答案为:H3BO3+H2O
B(OH)4-+H+,故答案为:H3BO3+H2O ![]() B(OH)4-+H+;
B(OH)4-+H+;
②酸性H2C2O4>HC2O4->H2CO3>H3BO3>HCO3-。向等浓度的H2C2O4 与H3BO3混合溶液中逐滴加入NaOH 溶液,首先与酸性强的粒子反应,然后再与酸性弱的粒子反应,则与OH- 作用的粒子依次为H2C2O4、 HC2O4- 、H3BO3,故答案为:H2C2O4、 HC2O4- 、H3BO3;
(3)酸性H2C2O4>HC2O4->H2CO3>H3BO3>HCO3-。根据酸性强的可以反应生成酸性弱的粒子,向NaHC2O4 溶液中加入少量的Na2CO3 溶液,反应的离子方程式为2HC2O4- 十CO32- =2C2O42-+H2O +CO2↑,故答案为:2HC2O4- 十CO32- =2C2O42-+H2O +CO2↑。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】猫头鹰体内有A种蛋白质,20种氨基酸;田鼠体内有B种蛋白质,20种氨基酸。猫头鹰捕食田鼠一小时后其消化道中的小肠上皮细胞中含有蛋白质种类和氨基酸种类最可能是( )
A. A+B,40 B. A,20 C. >A,20 D. <A,20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是( )
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是( )
A.K=![]()
B.K=![]()
C.增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D.改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)下列事实能用勒夏特列原理解释的是
A.使用催化剂,在单位时间内提高合成氨产率
B.对于2HI(g) ![]() H2(g)+2CO(g),达平衡后.缩小容器体积可使体系颜色变深
H2(g)+2CO(g),达平衡后.缩小容器体积可使体系颜色变深
C.对于2CaO2(s) ![]() 2CaO(s)+O2(g),达平衡后增大压强,再次平衡后O2的浓度保持不变
2CaO(s)+O2(g),达平衡后增大压强,再次平衡后O2的浓度保持不变
D.溴水中有下列平衡:Br(aq)+ H2O(l) ![]() HBr(aq)+HBrO(aq)当加入硝酸银溶液后,溶液颜色变浅
HBr(aq)+HBrO(aq)当加入硝酸银溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是 ( )
A. 磷脂是所有细胞必不可少的脂质
B. 所有生物的组成成分都有DNA
C. 只有多糖、蛋白质、脂肪三类生物大分子以碳链为骨架
D. 被形容为“生命的燃料”的物质是储存能量的淀粉或糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5 △H1
2H2(g)+O2(g)=2H2O(g)△H2
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为______(用△H1、△H2、△H3表示)
A.12△H3+5△H2-2△H1 B.2△H1 -5△H2- 12△H3
C.12△H3-5△H2-2△H1 D.△H1 -5△H2 -12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组在实验室利用甲烷与氯气反应制取副产品盐酸,其设计的装置如下:
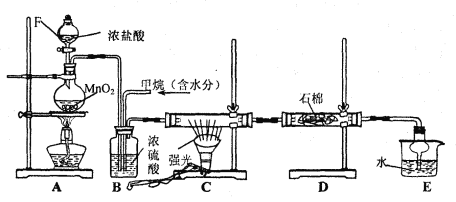
根据要求填空:
(1) 写出CH4与Cl2生成一氯代物的化学反应方程式 ;
(2) B装置有三种功能:①控制气体流速;②将气体混合均匀;③________________;
(3) D装置中的石棉上吸附着KI饱和液及KI粉末,其作用是 ;
(4) E装置的作用是____________(填编号);
A.收集气体 B.防止倒吸 C.吸收氯气 D.吸收氯化氢
(5) E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 。
(6) 该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是___________(填编号)。
A.CH3Cl B.CH2Cl2 C.CHCl3 D.CCl4 E.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
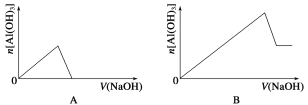
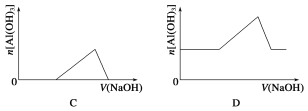
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com