
【题目】下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
科目:高中化学 来源: 题型:
【题目】为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。请回答下列问题:
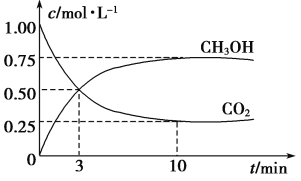
(1) 达平衡时,氢气的平衡浓度为C(H2)= 。
(2) 能够说明该反应已达到平衡的是 (填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3 mol H2的同时生成1 mol CH3OH
(3)下列措施中能使平衡混合物中![]() 增大的是______________。
增大的是______________。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
(4) 求此温度(T)下该反应的平衡常数K = 。若开始时向该1 L密闭容器中充入1 mol CO2,2molH2,1.5mol CH3OH和1 mol H2O(g),则反应向 (填“正”或“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A. 168mL B. 224mL C. 504mL D. 336mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 人类目前所直接利用的能源大部分是由化学反应产生的
B. 煤,石油,天然气是当今世界最重要的三种化石燃料
C. 最理想的能源是煤炭
D. 人体运动所消耗的能量与化学反应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl混合溶液aL,将它均分成两份。一份滴加硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗xmolH2SO4、ymolAgNO3.据此得知原混合溶液中的c(Na+)为
A. (2y-4x) /amol·L-1 B. (y-2x) /amol·L-1
C. (2y-2x) /amol·L-1 D. (y-x) /amol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质<括号内为杂质)选用的试剂和分离方法部正确的是
物质 | 试剂 | 分离方法 | |
① | CuCl2(FeCl3) | CuO | 过滤 |
② | Cl2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
③ | 乙醇(水) | 金属钠 | 蒸馏 |
④ | NaCl溶液(Na2S) | AgCl | 过滤 |
A. ①③ B. ①④ C. 只有② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4︰4︰5︰1︰1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl。回答下列问题。
(1)元素D在周期表中的位置是 ,B原子的外围电子排布图为 。E原子的核外有 种不同运动状态的电子,B和C的第一电离能大小关系是 。(用元素符号表示)
(2)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1︰1和l︰2,写出原子个数比为1︰1的化合物的电子式 ,两种化合物可以任意比互溶,解释其主要原因为 。
(3)该配位化合物的化学式为 。
(4)A元素与B元素可形成分子式为A2B2的化合物,该化合物的分子具有平面结构,则其结构式为 ,用电子式表示化合物Na2D的形成过程 。
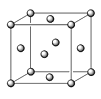
(5)已知E的晶胞结构如图所示,此晶胞立方体的边长为a cm,E单质的密度为ρ g·cm-3,则阿伏伽德罗常数为 (用a、ρ表示)。该晶胞配位数为 ,EDC4常作电镀液,其中DC42-的空间构型是 ,其中D原子的杂化轨道类型是 。若电解EDC4的水溶液,则电解总反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com